Als innere Energie bezeichnet man die Summe der verschiedenen Energieformen auf mikroskopischer Ebene im Inneren eines Stoffes.
Energieübertragung durch Wärme und Arbeit
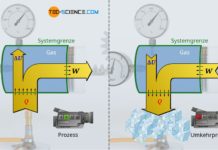
Im Artikel Die Prozessgrößen: Wärme und Arbeit wurde ausführlich erläutert, dass einem beliebigen Stoff Energie in Form von Arbeit und/oder Wärme zugeführt werden kann. Die zugeführte Energie nimmt der Stoff in seinem Inneren entsprechend auf. Dies kann sich dann auf unterschiedliche Weise im Stoff bemerkbar machen. Auf die unterschiedlichen Energieformen, denen eine Energieübertragung in Form von Wärme und Arbeit, zugute kommen kann, wird im Folgenden näher eingegangen.

Thermische Energie
Bei einem Gas bspw. kommt eine Energiezufuhr durch Wärme der Erhöhung der Bewegungsenergie der Teilchen zugute. Dies wiederum macht sich dann direkt in der Erhöhung der Temperatur bemerkbar. Auch bei Aufwendung von mechanischer Arbeit durch einen Kompressionsvorgang wird die dabei zugeführte Energie letztlich der Bewegungsenergie der Teilchen zugute kommen und die Temperatur des Gases damit ansteigen (siehe hierzu auch den Artikel Warum erhöhen sich Druck und Temperatur bei der Kompression eines Gases?).
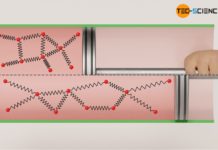
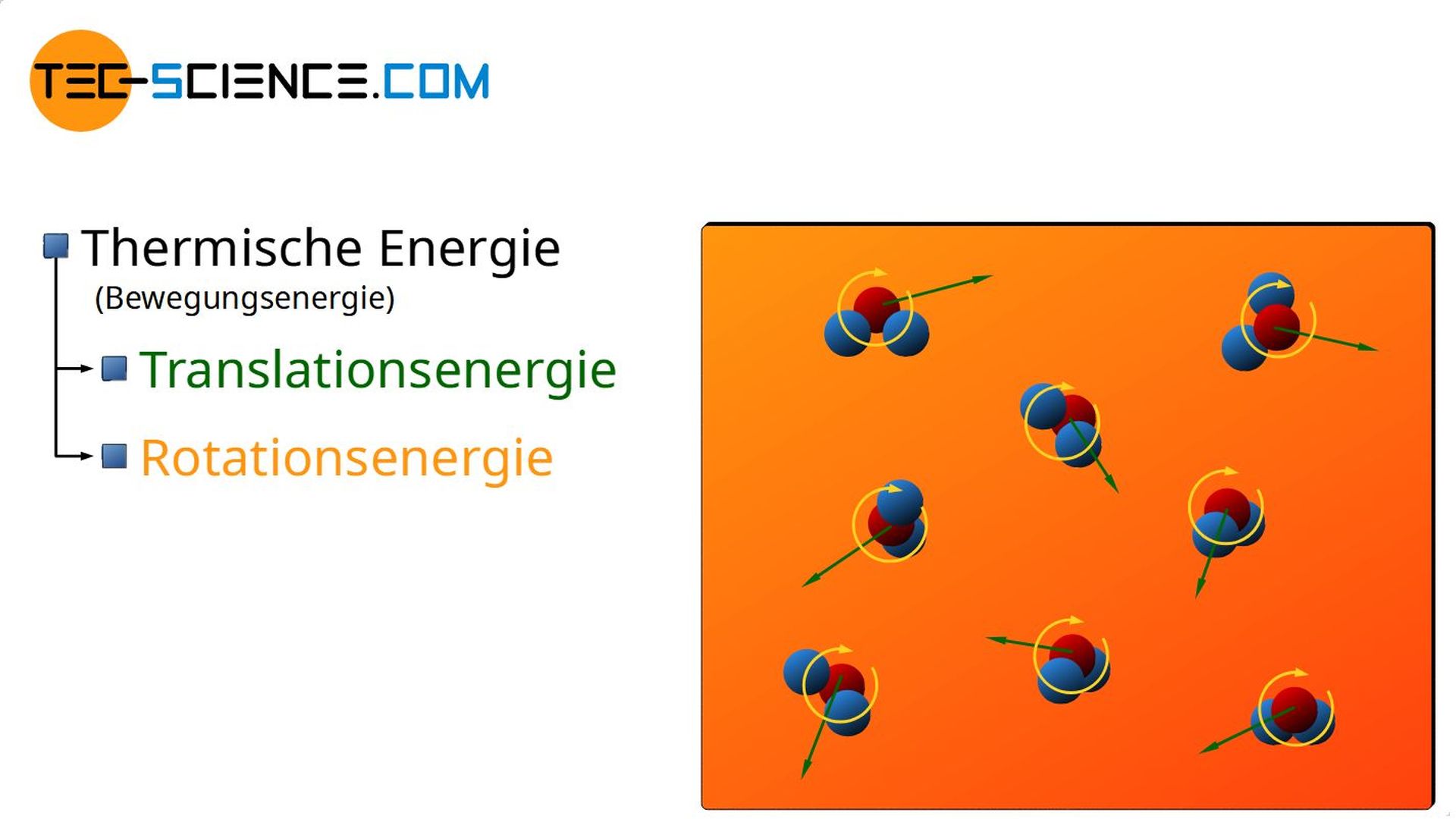
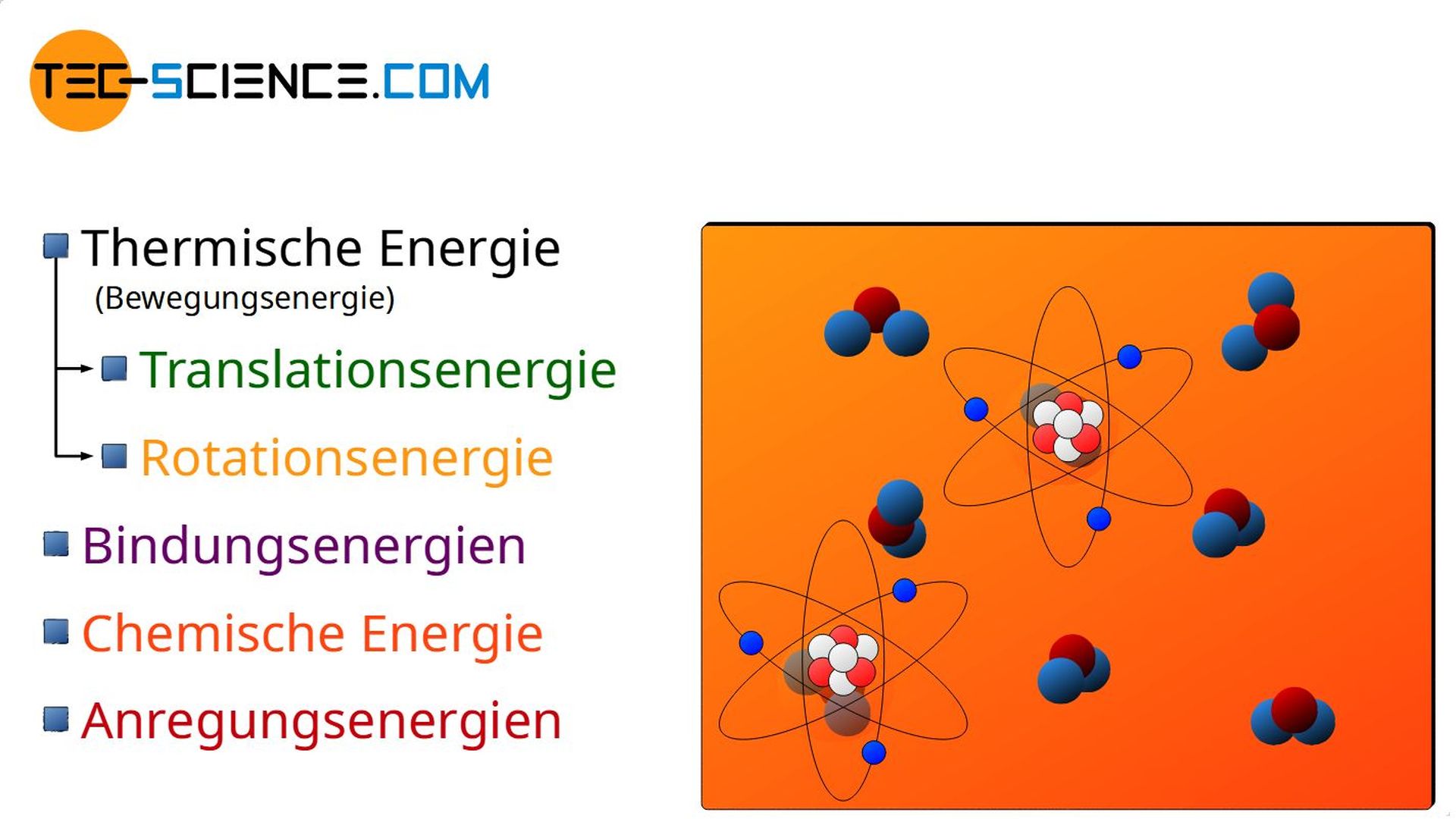
Die Bewegungsenergie der Moleküle umfasst sowohl die translatorische Bewegung der Massenschwerpunkte, als auch eine mögliche Rotationsbewegung der Moleküle um ihren Massenschwerpunkt. Diese grundsätzlich ungeordneten Bewegungsenergien werden allgemein auch unter dem Begriff der thermischen Energie zusammengefasst (siehe hierzu auch den Artikel Gleichverteilungssatz).
Als thermische Energie bezeichnet man die Bewegungsenergie der Teilchen, die sich aus der ungeordneten Teilchenbewegung ergibt.
Der Begriff ungeordnet im Zusammenhang mit der Teilchenbewegung bezieht sich dabei auf die Tatsache, dass bspw. Wasser in einem Glas, welches sich in einem schnell fahrenden Fahrzeug befindet, keine erhöhte thermische Energie besitzt nur weil sich die Teilchen im Stoff mit der erhöhten Geschwindigkeit des Autos mit bewegen. Das Wasser wird ja für einen außenstehenden Beobachter am Straßenrand nicht wärmer, nur weil es sich nun insgesamt schneller bewegt. In diesem Fall wird die ungeordnete Teilchenbewegung (maßgebend für die thermische Energie und damit die Temperatur) lediglich mit der geordneten Bewegung des Autos überlagert.
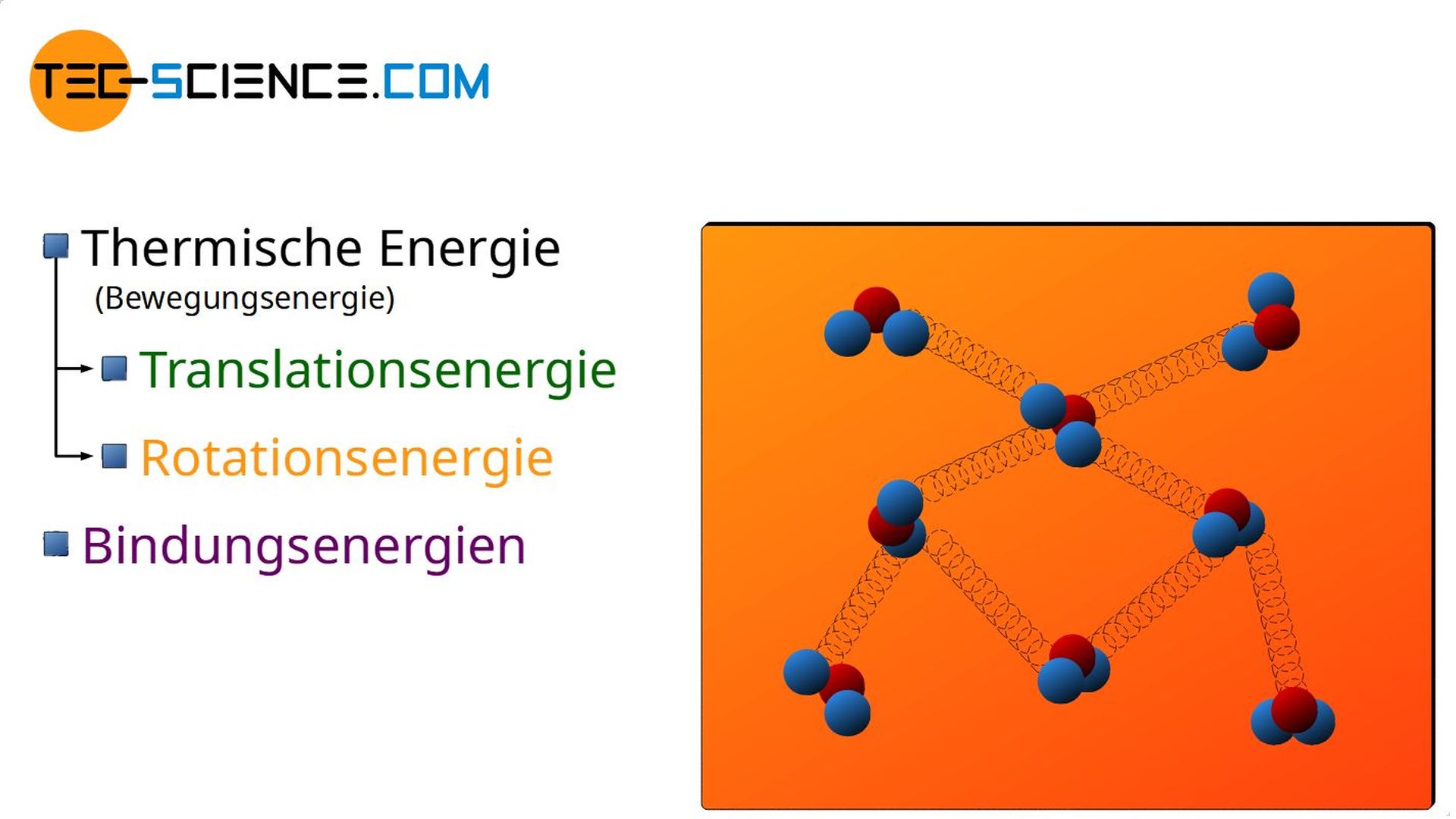
Bindungsenergie
Die Zufuhr von mechanischer Energie und/oder von Wärmeenergie hat bei Gasen hat also hauptsächlich Auswirkungen auf die Bewegungsenergie der Teilchen und damit auf die Temperatur. Bei Flüssigkeiten oder Festkörpern können sich die zugeführten Energien jedoch noch auf andere Weise bemerkbar machen.
So kann eine zugeführte Wärmeenergie bspw. zur Änderung der Bindungsenergien führen. Dies wird bei Aggregatzustandsänderungen der Fall sein. So wird beim Verdampfen von Flüssigkeiten die zugeführte Wärmeenergie nicht genutzt um den Teilchen mehr Bewegungsenergie zu verleihen (die Temperatur bleibt deshalb während der Aggregatzustandsänderung konstant!), sondern die Bindungskräfte zu „lockern“ um den Stoff in den gasförmigen Zustand zu überführen.
Aber nicht nur Energie in Form von Wärme, sondern auch eine mechanische Energiezufuhr kann Auswirkungen auf die Bindungsenergien nehmen. Wird ein gasförmiger Stoff unter Arbeitsaufwand (mechanische Energiezufuhr) komprimiert, so kann das Gas bei hohen Drücken ebenfalls den Aggregatzustand ändern und sich wieder verflüssigen. Dies ist zum Beispiel bei Propan-Gasflaschen der Fall, bei denen das Propangas so stark komprimiert wurde, dass es letztlich in flüssiger Form in der Gasflasche vorliegt. Erst bei der Expansion auf Umgebungsdruck vergast die Flüssigkeit wieder. Die zugeführte Kompressionsarbeit beim Verflüssigen hat offensichtlich ebenfalls Auswirkungen auf die Bindungsenergien.
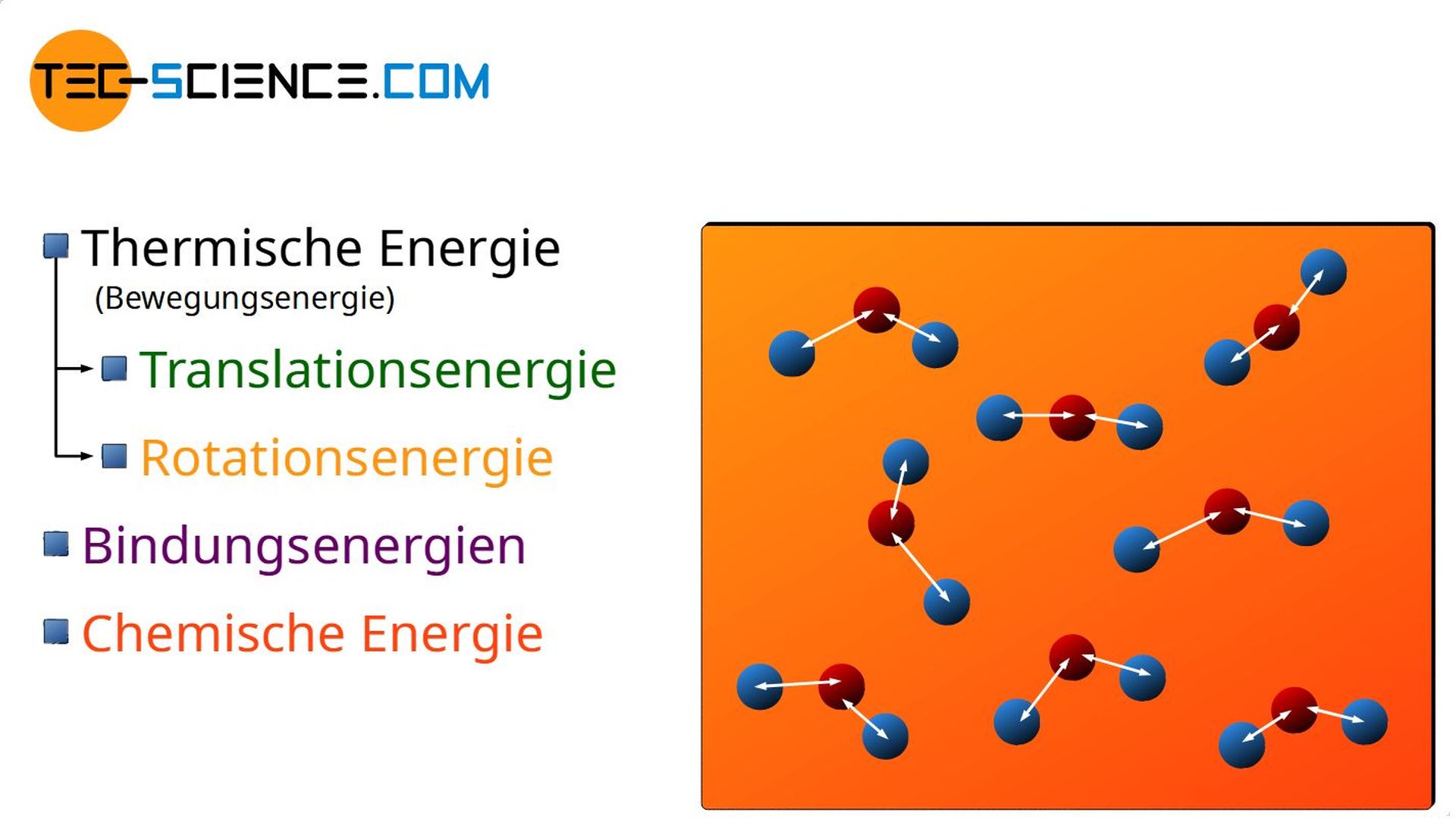
Chemische Energie und Anregungsenergie
Eine weitere Möglichkeit, wie sich eine Energiezufuhr in Stoffen bemerkbar machen kann, zeigt das Aufladen eines Akkus. Die Zufuhr von elektrischer Energie (die in der Thermodynamik ebenfalls zu den Arbeitsumsätzen zählt!) setzt in diesem Fall chemische Prozesse in Gang. Die zugeführte Arbeit kommt in einem solchen Fall also der chemischen Energie des Stoffes zugute.
Darüber hinaus zeigt sich bspw. bei Leuchtstoffröhren eine weitere Möglichkeit wie sich eine (elektrische) Energiezufuhr in einem Stoff bemerkbar machen kann. So werden durch die Energiezufuhr die Atome eines fluoreszierenden Gases zum Leuchten angeregt. Die Energiezufuhr zeigt sich also in Form von Anregungsenergien.
Innere Energie
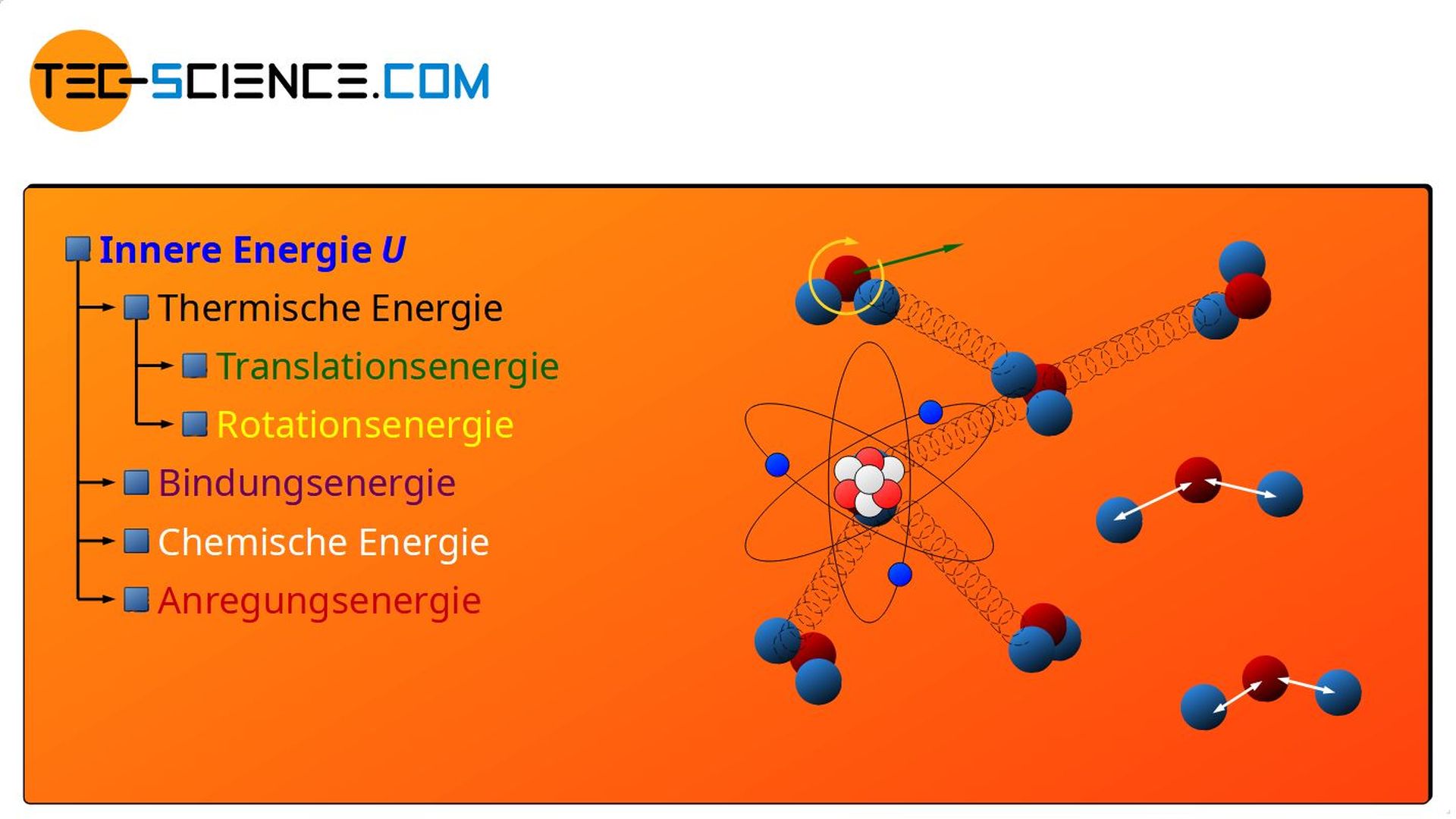
Die oben genannten Beispiele zeigen, dass die von außen Zufuhr von Energie (in Form von Wärme und/oder Arbeit), den unterschiedlichsten Energieformen zugute kommen kann, die ein Stoff in seinem Inneren besitzt. Hierzu zählen unter anderem die oben aufgeführten Energieformen wie:
- Thermische Energie („ungeordnete“ Bewegungsenergie in Form von Translation und Rotation),
- Bindungsenergie,
- Chemische Energie und
- Anregungsenergie
An dieser Stelle ließen sich sicherlich noch mehr Energieformen im Inneren eines Stoffes finden, denen eine Energiezufuhr zugute kommen könnte. Diese Auflistung erhebt deshalb keinen Anspruch auf Vollständigkeit! Aber alle diese Energieformen, die prinzipiell im Inneren eines Stoffes vorhanden sein können, werden unter dem Begriff der inneren Energie zusammengefasst!
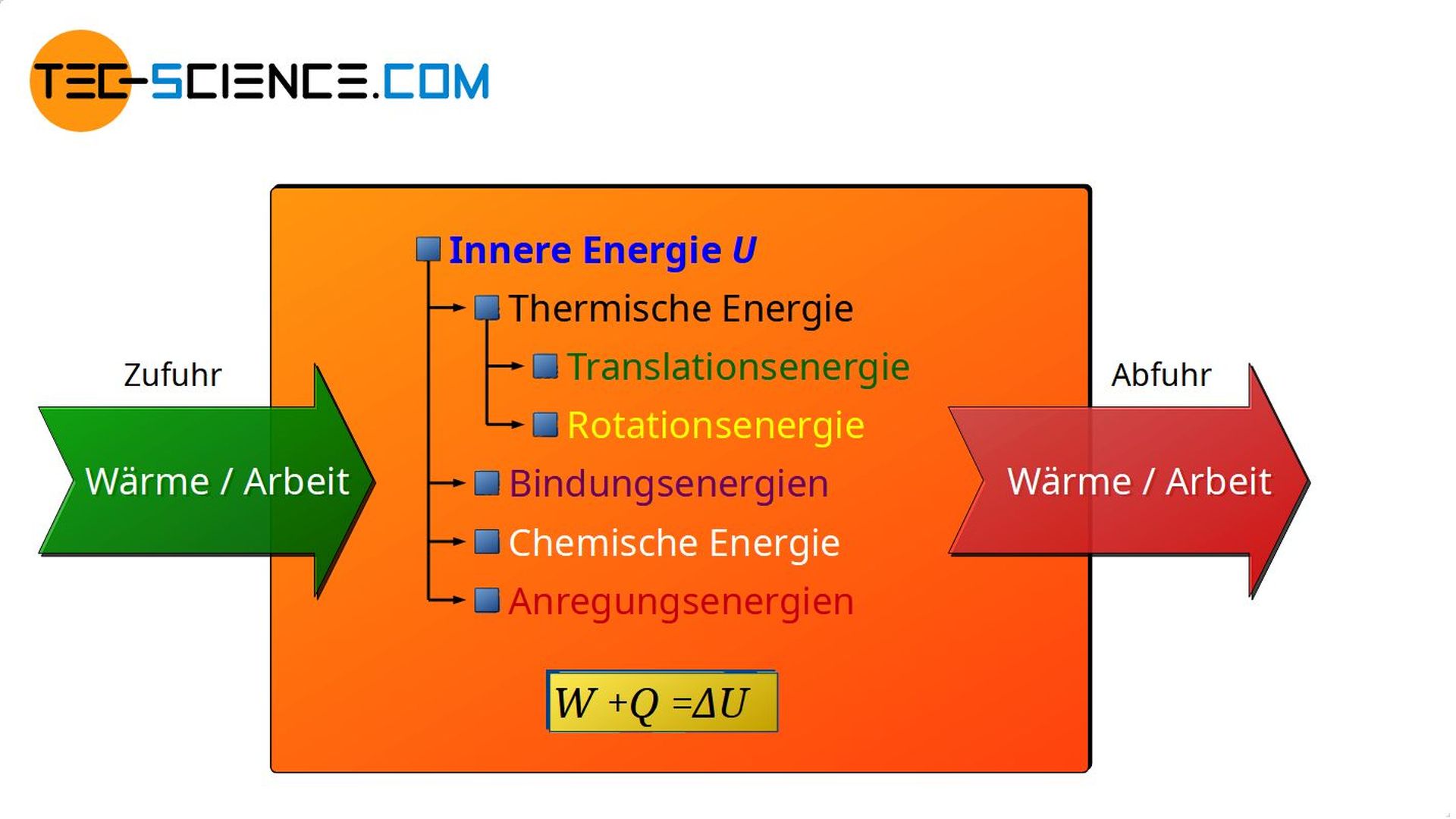
Deshalb gilt ganz allgemein: Wird einem Stoff Energie in Form von Wärme oder mechanischer Arbeit zugeführt, so geschieht dies stets zu Gunsten der inneren Energie. Die innere Energie des Stoffes wird sich in diesem Fall erhöhen. Welche Energieformen hiervon dann genau betroffen sind (ob thermische Energie, Bindungsenergie, chemische Energie, Anregungsenergie oder einer Kombination hiervon) hängt dann letztlich vom Stoff und von den genaueren Randbedingungen ab.
Gibt umgekehrt ein Stoff Wärmeenergie oder mechanische Arbeit an die Umgebung ab, so wird dies stets auf Kosten seiner inneren Energie geschehen. In einem solchen Fall wird sich die innere Energie folglich verringern. Ob hiervon dann die thermische Energie, die Bindungsenergien, die chemische Energien oder Anregungsenergien betroffen sind, hängt wiederum vom Stoff und von den detaillierten Randbedingungen ab.
Erster Hauptsatz der Thermodynamik
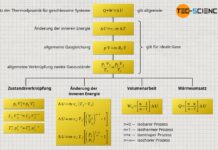
Wärmeumsätze Q und Arbeitsumsätze W die an einem Stoff (an einem thermodynamischen System) bzw. von einem Stoff vorgenommen werden, sind demzufolge nicht einfach verschwunden bzw. tauchen aus dem Nichts auf, sondern sie führen zur Änderung der inneren Energie ΔU des Stoffes. Diese Aussage des Energieerhaltungssatzes bezeichnet man auch als Ersten Hauptsatz der Thermodynamik. Mathematisch lässt sich der Erste Hauptsatz der Thermodynamik wie folgt ausdrücken:
\begin{align}\;\;\;\;\;
&\boxed{ Q+W=\Delta U } \\[5px]
\end{align}
Im Gegensatz zu den Prozessgrößen Wärme und Arbeit, die den Prozess der Energiezufuhr und/oder Energieabfuhr beschreiben, ist die innere Energie eine Zustandsgröße, die den energetischen Zustand des Stoffes im Inneren beschreibt!
Vergrößert sich die innere Energie eines Stoffes so ist mathematisch betrachtet die Änderung der inneren Energie positiv (ΔU>0). Umgekehrt ist die Änderung der inneren Energie negativ (ΔU<0), wenn sich die innere Energie verringert. Hieraus ergibt sich dann folgende Vorzeichenkonvention für die Wärme- bzw. Arbeitsumsätze:
Wird einem Stoff Wärme bzw. Arbeit zugeführt, so werden diese Energieumsätze positiv gezählt (Q>0 bzw. W>0). Gibt der Stoff hingegen Wärme bzw. Arbeit an seine Umgebung ab, so zählt man diese Energieumsätze negativ (Q<0 bzw. W<0)!
Beachte die Terminologie für Gase
- Arbeit wird am Gas verrichtet: Energietransfer von der Umgebung auf das Gas durch Kompression -> W>0
- Arbeit wird vom Gas verrichtet: Energietransfer vom Gas auf die Umgebung durch Expansion -> W<0
- Erwärmung eines Gases: Energietransfer von der Umgebung auf das Gas durch Wärmezufuhr -> Q>0
- Abkühlung eines Gases: Energietransfer vom Gas auf die Umgebung durch Wärmeabfuhr -> Q<0
Änderung der Inneren Energie
Beachte, dass der Erste Hauptsatz der Thermodynamik lediglich eine Aussage über die Änderung der inneren Energie eines Stoffes macht! Wie groß die innere Energie U eines Stoffes in ihrer Gesamtheit ist, lässt sich aufgrund der vielen beinhalteten Energieformen und der enormen Teilchenanzahl in der Praxis nicht ermitteln. Lediglich für idealisierte Modellvorstellungen wie bspw. bei idealen Gasen ist eine solche absolute Bestimmung der inneren Energie möglich.
Es wird nun auch deutlich, dass ein Stoff grundsätzlich keine Wärme besitzt, sondern im Inneren des Stoffes nur die innere Energie als Energieform existiert (in welcher genaueren Ausprägung auch immer). Denn ob die innere Energie durch eine Arbeitszufuhr oder eine Wärmezufuhr geändert wurde, kann im Nachhinein ohnehin nicht festgestellt werden.
Man stelle sich hierzu in Gedanken ein Festkörper am Absoluten Nullpunkt vor. Die im Stoff enthaltenen Teilchen besitzen somit zunächst keinerlei Bewegungsenergie. In Gedanken versetzt man nun die Gitterstruktur durch Hammerschläge in Schwingung (mechanische Energiezufuhr). Der Festkörper gelangt also auf rein mechanische Weise zu seiner Temperatur, ohne dass diesem jemals so etwas wie Wärmeenergie zugeführt worden wäre. Deshalb kann auch Wärme (oder auch Arbeit) niemals Inhalt eines Stoffes sein.

Wärme bezeichnet in der Thermodynamik lediglich die Energieübertragung von einem heißeren Gegenstand auf einen kühleren Gegenstand durch Stoßprozesse der Teilchen untereinander oder durch Strahlung (siehe hierzu auch den Artikel Wärme und thermodynamisches Gleichgewicht).