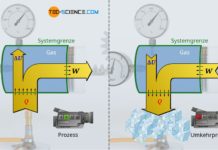
Ein System ist ein Raumbereich, innerhalb dessen thermodynamische Prozesse ablaufen. Die Systemgrenze grenzt das System zur Umgebung ab.
Definition des Begriffs des thermodynamischen Systems
Um thermodynamische Prozesse zu beschreiben, muss man sich zunächst darauf verständigen, was nun genau beschrieben werden soll. Dies führt zum Begriff des thermodynamischen Systems (kurz: System), innerhalb dessen thermodynamische Zustandsänderungen ablaufen und darin beschrieben werden. Dabei bezeichnet man als System ganz allgemein einen Raumbereich innerhalb dessen sich ein Stoff (z.B. Gas) in verschiedenen Zuständen befindet. Dieses System wird unter anderem durch die thermodynamischen Zustandsgrößen wie Druck, Volumen, Temperatur und Masse beschrieben.
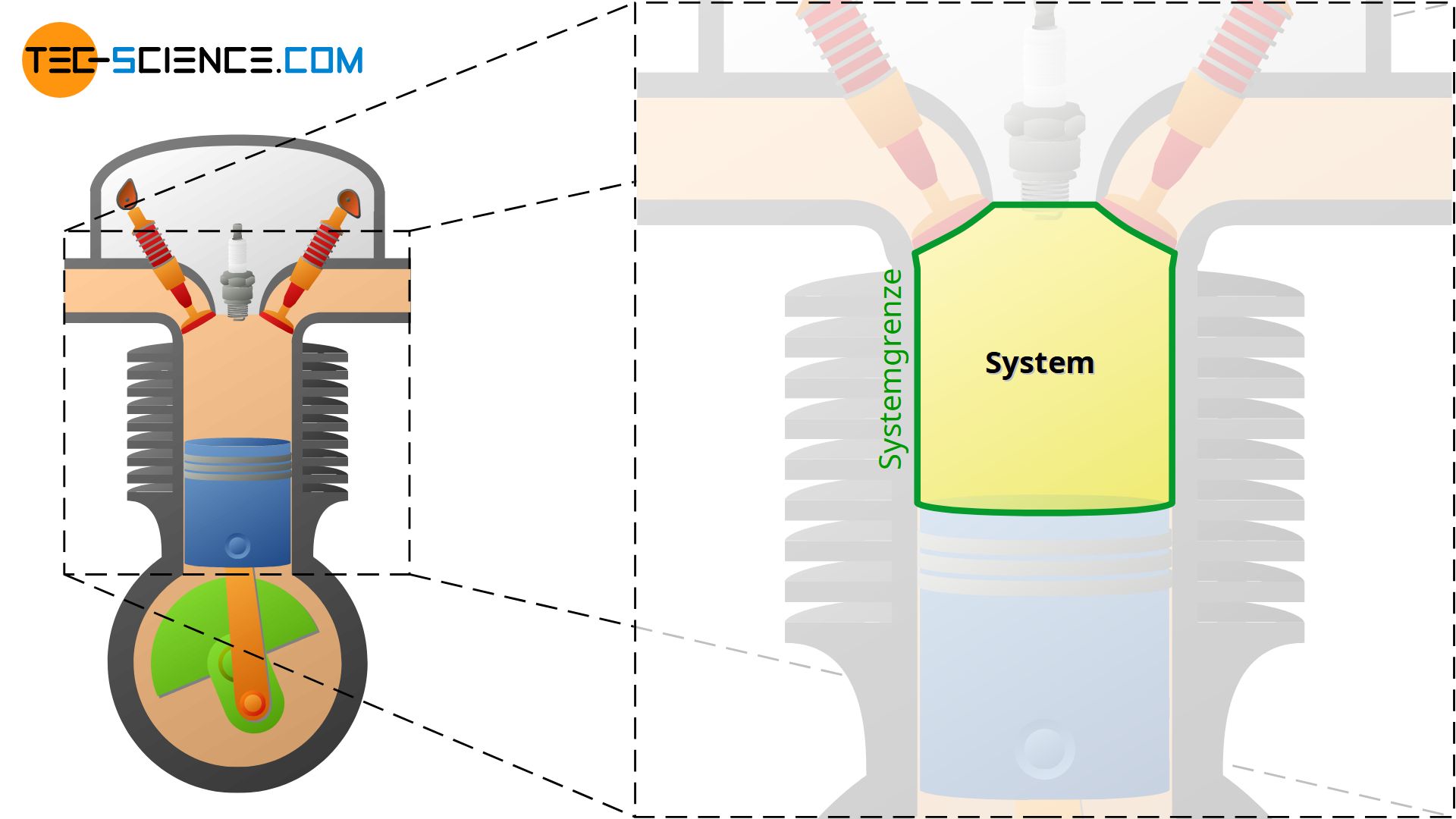
Soll bspw. der Verbrennungsprozess in einem Verbrennungsmotor beschrieben werden, dann stellt der Raum im Zylinder das thermodynamische System dar. Die stattfindenden Zustandsänderungen des darin eingeschlossenen Gases durch Erwärmung, Abkühlung, Expansion und Kompression wird dann innerhalb dieses Systems beschrieben.
Das System ist in diesem Fall begrenzt durch die Zylinderinnenfläche und die Kolbenfläche. Eine solche Grenze des Raumbereiches wird auch als Systemgrenze bezeichnet. Die Systemgrenze grenzt also das eigentliche thermodynamische System von der Umgebung ab. Wie das Beispiel des Motors zeigt, muss die Systemgrenze bzw. das thermodynamische System nicht notwendigerweise starr sein, sondern kann sich während des Prozesses vergrößern (Expansion) oder verkleinern (Kompression)!
Ein System ist ein Raumbereich, innerhalb dessen thermodynamische Prozesse beschrieben werden. Das System ist zur Umgebung hin durch die Systemgrenze abgegrenzt.
Änderung des Zustandes eines Systems durch Energieaustausch
Im allgemeinen Fall, kann ein System über die Systemgrenze hinweg Energie in Form von Wärme und Arbeit mit der Umgebung austauschen werden, d.h. Energie vom System an die Umgebung abgegeben werden (Abkühlung oder Expansion) oder Energie von der Umgebung auf das Gas übertragen werden (Erwärmung oder Kompression). Auch ein Austausch von Masse ist zwischen System und Umgebung im Allgemeinen möglich. Durch den Austausch von Energie oder Masse ändert sich der Zustand des thermodynamischen Systems.
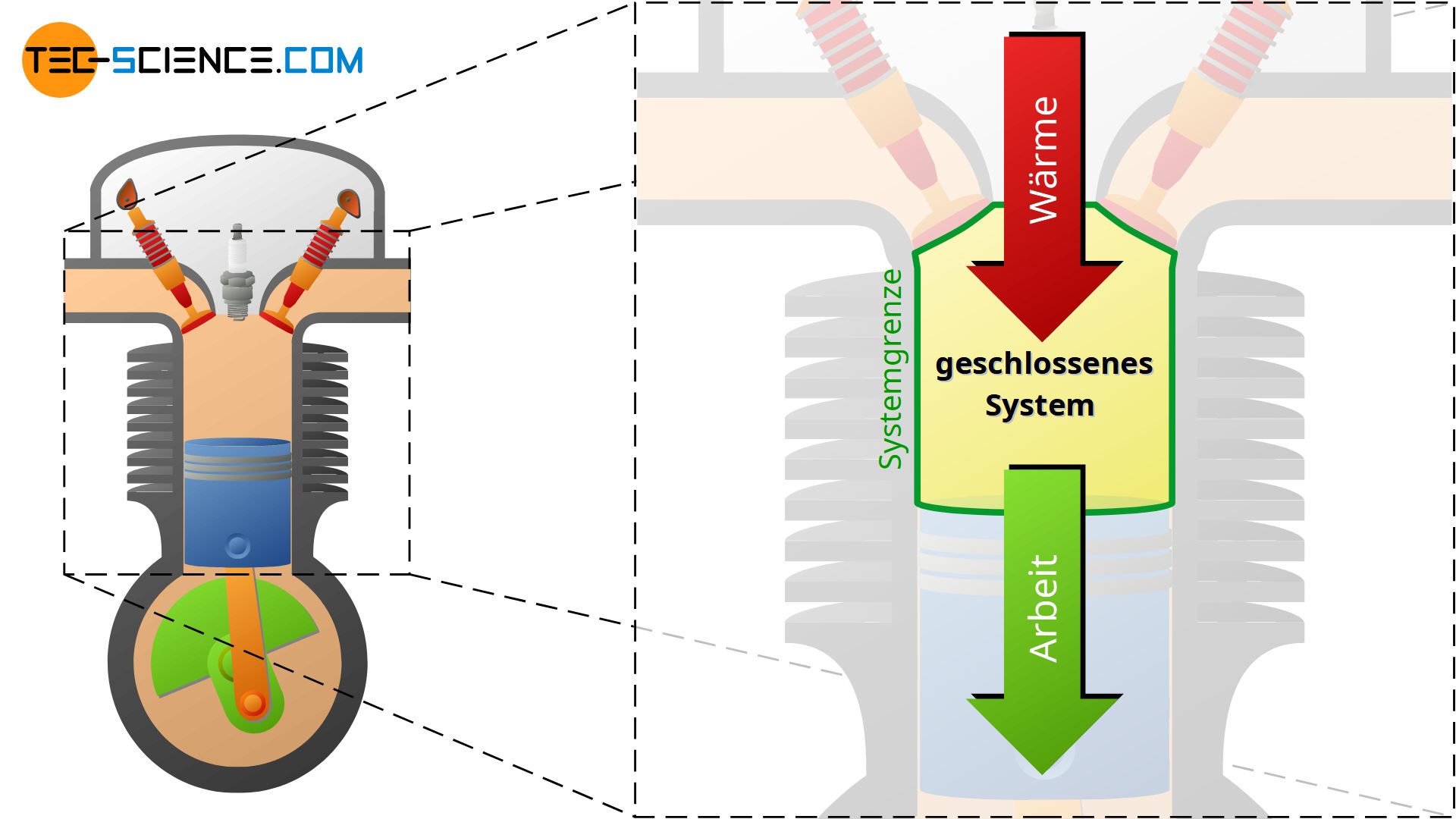
Am Beispiel eines 4-Takt-Verbrennungsmotor soll dies verdeutlich werden. So wird dem gasförmigen Treibstoff-Luft-Gemisch während des Verbrennungsvorgang Wärme zugeführt. Dies führt zu einer Temperatur- und Druckerhöhung (Änderung des Zustandes des Systems durch Wärmezufuhr). Anschließend findet der Expansionsvorgang durch die sich ausdehnenden Gase statt. Die heißen Gase drücken durch den großen Druck den Kolben nach unten. Dabei gibt das Gas Arbeit über die Systemgrenze an die Umgebung ab, d.h. mechanische Energie wird in diesem Fall vom Gas auf das Pleuel und anschließend auf die Kurbelwelle übertragen. Druck und Temperatur nehmen während des Expansionsvorgangs wieder ab (Änderung des Zustandes des Systems durch Abfuhr von Arbeit).
Bedeutung der Systemgrenze am Beispiel eines Triebwerks
Der Begriff des Systems bzw. der Systemgrenze ist zunächst sehr abstrakt. Die Festlegung der Systemgrenze ist aber von entscheidender Bedeutung, wenn es um die Beschreibung von thermodynamischen Prozessen geht. Denn je nach Festlegung werden unter Umständen gänzlich unterschiedliche thermodynamische Vorgänge beschrieben. Am Beispiel eines Mantelstromtriebwerks soll dies verdeutlicht werden.

Die angesaugte Luft wird bei einem Mantelstromtriebwerk zunächst in zwei Teilströme aufgeteilt: in einen Kernstrom und in einen Mantelstrom, der über einen Bypass um die Turbine geleitet wird. Der Kernstrom wird also vom Mantelstrom ummantelt, was diesem Triebwerkstype dessen Namen verleiht. Der Kernstrom wird durch das Kerntriebwerk und die Brennkammer geleitet und sorgt für den Antrieb der eigentlichen Turbine, während der Mantelstrom durch das Rückstoßprinzip den hauptsächlichen Vortrieb mit etwa 85 % erzeugt (nur 15 % des Schubs kommen durch den Kernstrom zustande).
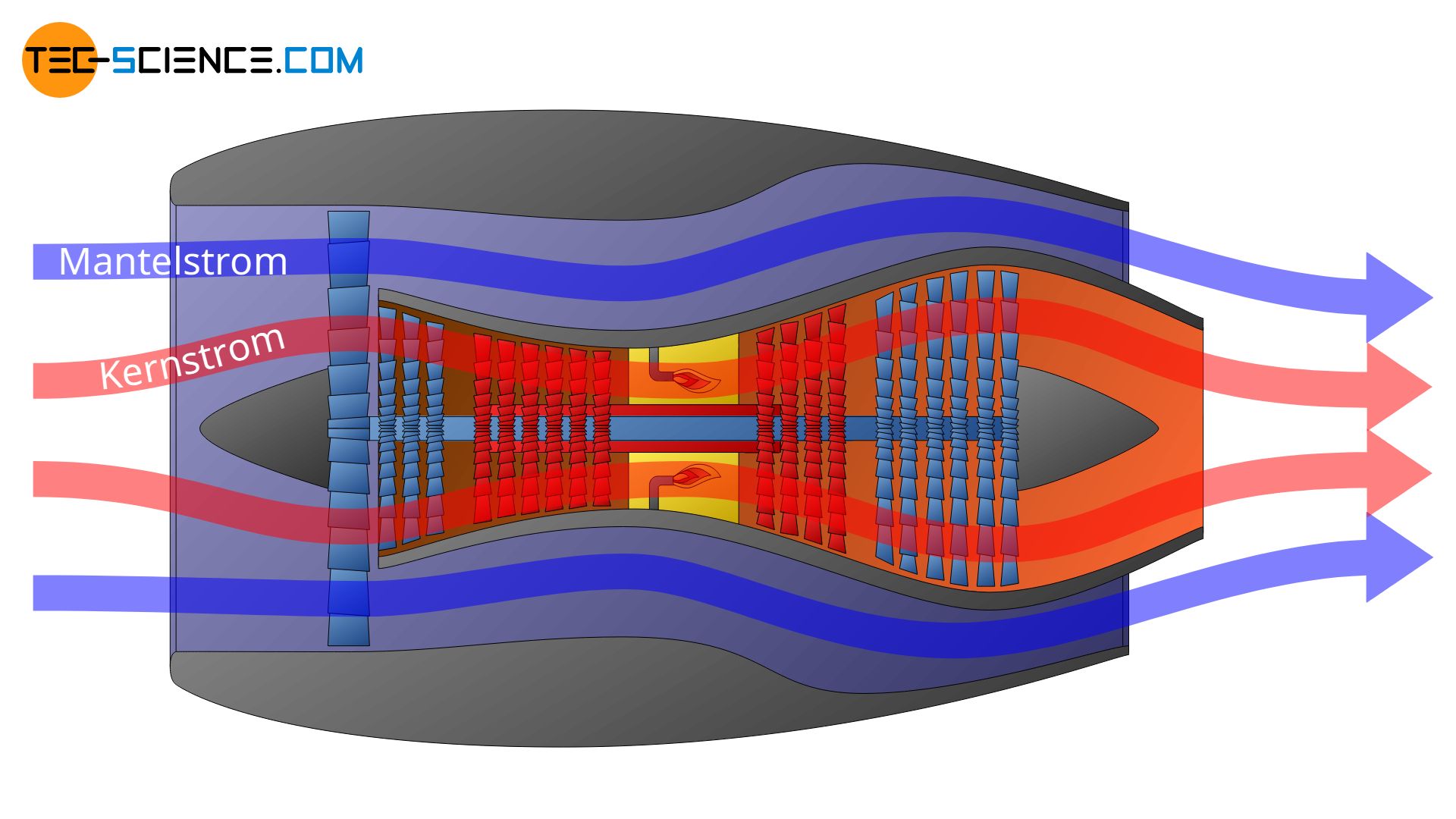
Je nachdem wie die Systemgrenze nun gelegt wird, zeigen sich nun ganz unterschiedliche thermodynamische Beschreibungen. Im ersten der unten abgebildeten Fälle wird lediglich die Zustandsänderung des Mantelstroms beschrieben. Im zweiten Fall erfolgt nur die thermodynamische Beschreibung des Kernstroms.
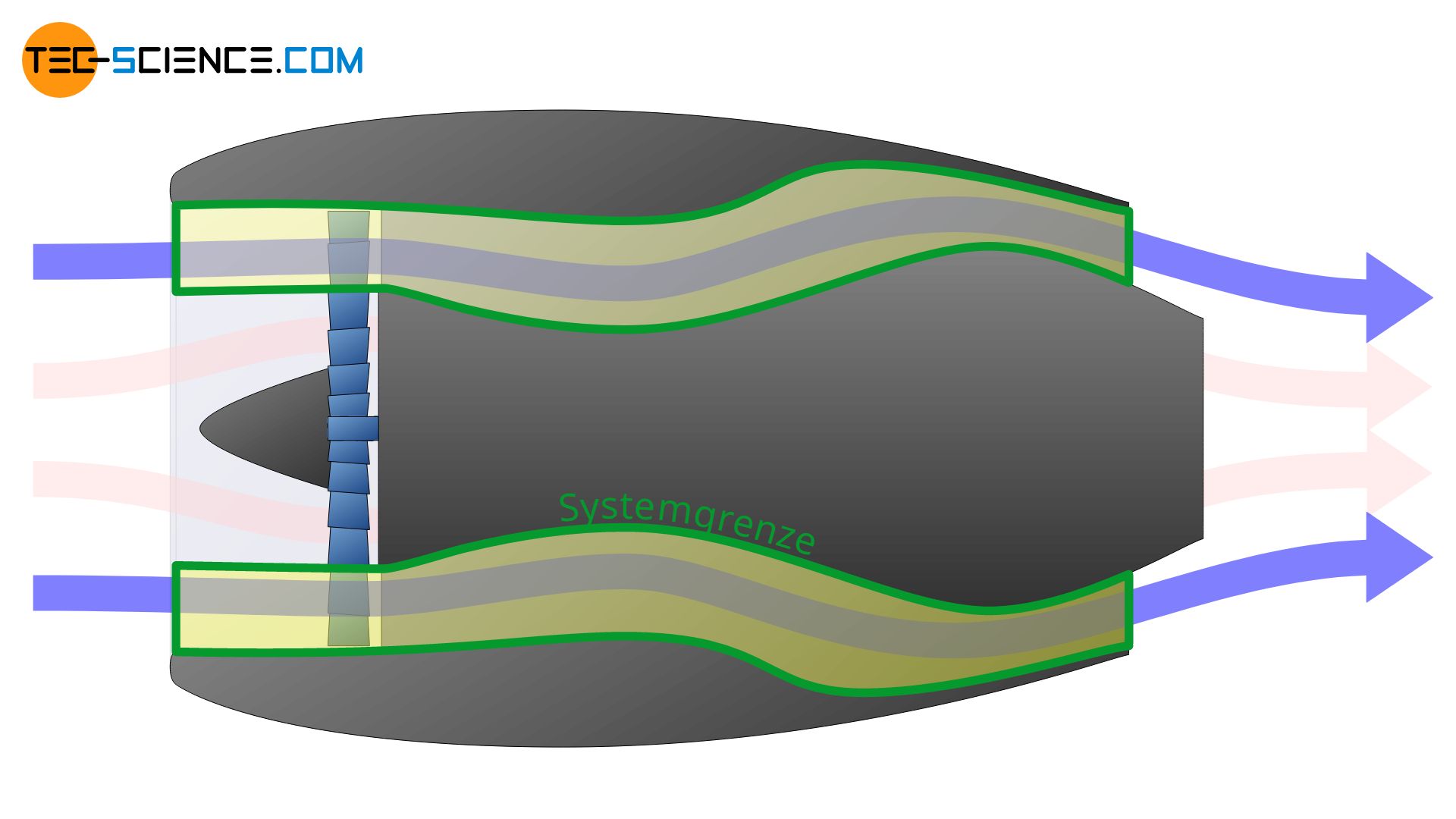
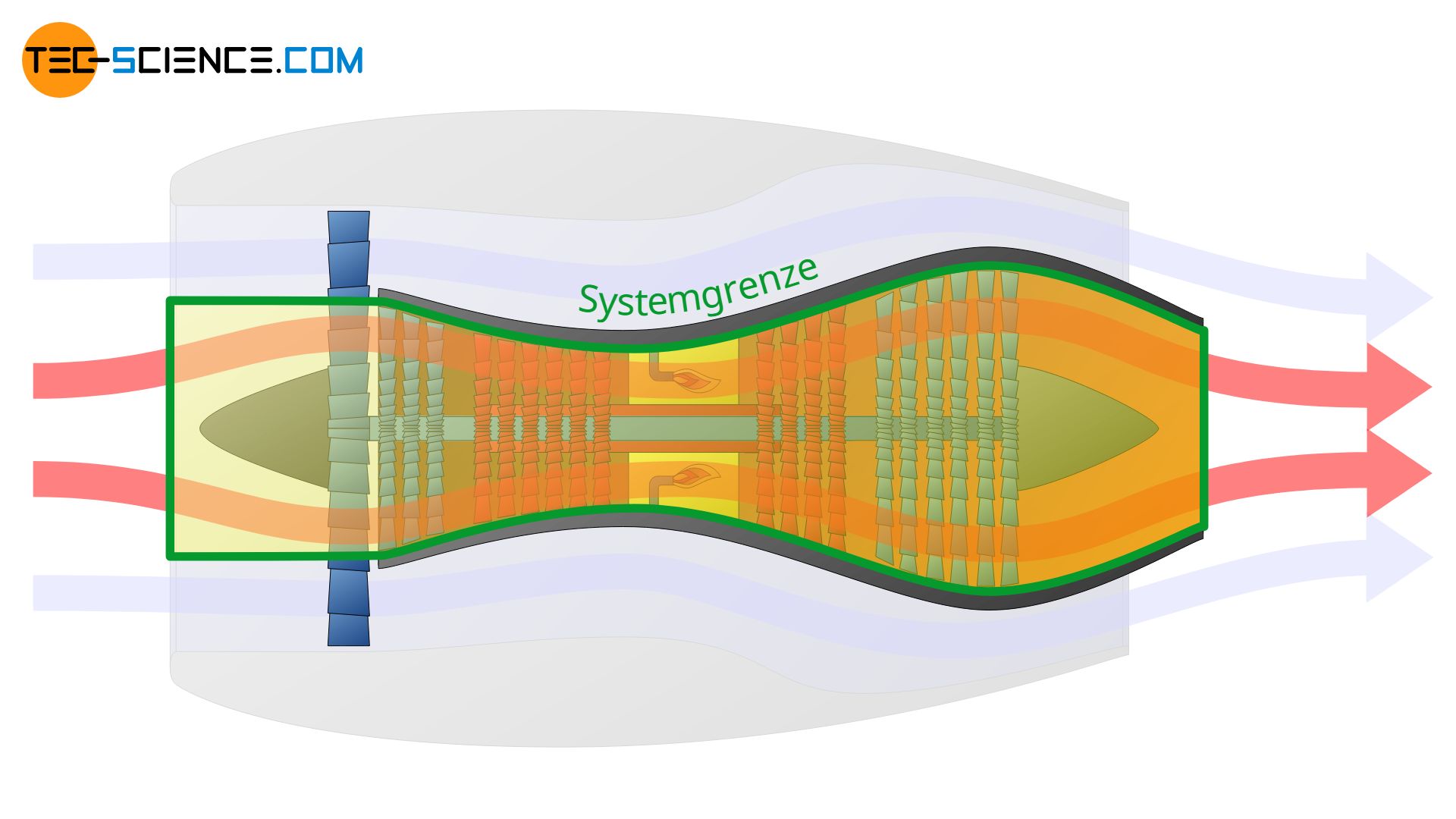
Die Systemgrenze kann aber auch lediglich um die Brennkammer gelegt werden. In diesem Fall werden dann nur die thermodynamischen Vorgänge innerhalb der Brennkammer beschrieben. Man sieht also, dass die Festlegung der Systemgrenze entscheidend für den gesamten Prozess ist, der beschrieben werden soll.
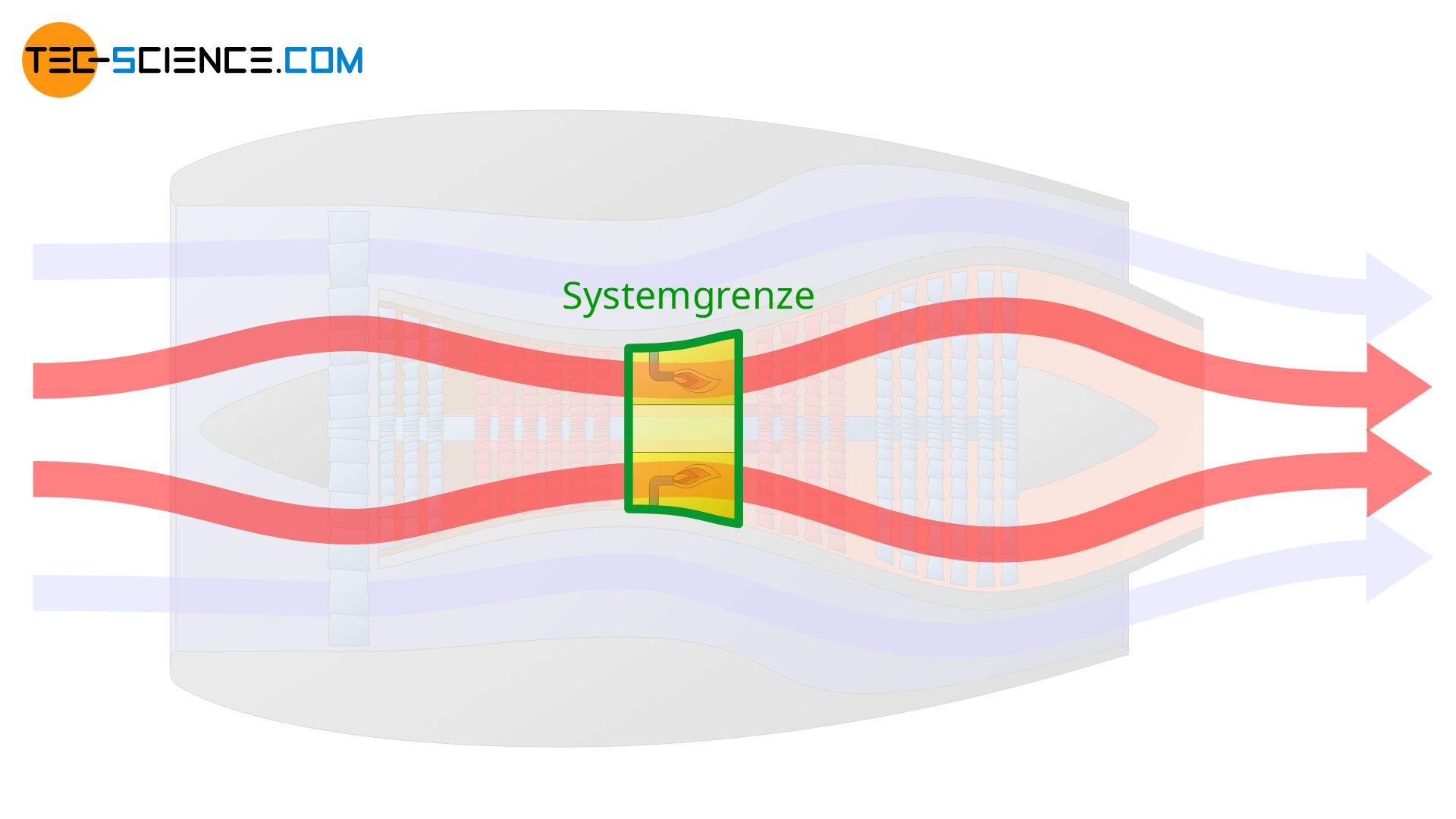
Arten von thermodynamischen Systemen
Je nachdem, welchen Einschränkungen die Durchlässigkeit der Systemgrenze unterliegt, unterscheidet man unterschiedliche thermodynamischen Systeme. Auf diese wird in den folgenden Abschnitten näher eingegangen.
Offene thermodynamische Systeme
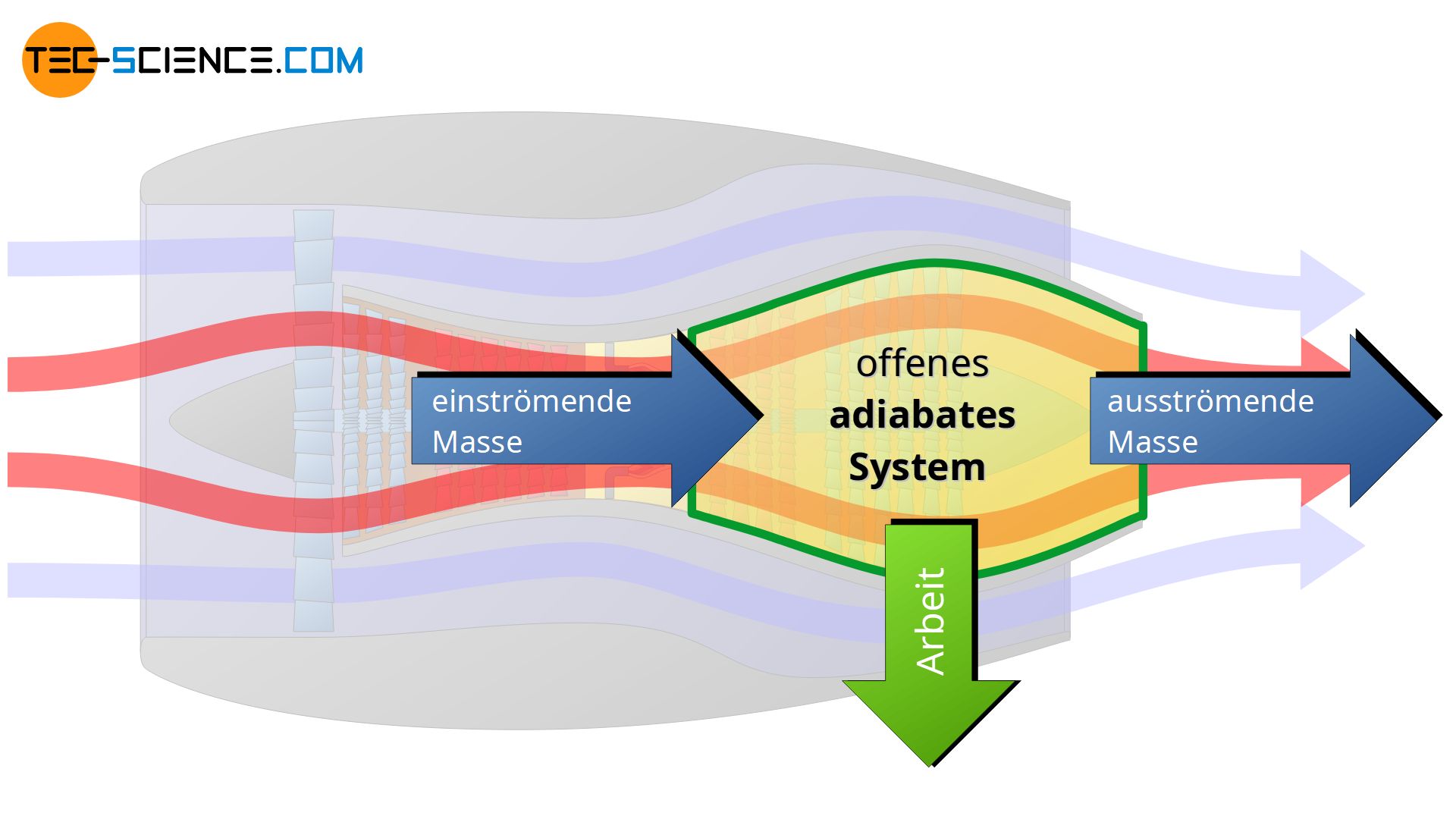
Ein offenes System kann über die Systemgrenze hinweg Energie in Form von mechanischer Arbeit oder Wärme transportieren und umgekehrt, d.h. von der Umgebung kann Arbeit und Wärme auf das System übertragen werden. Darüber hinaus kann das offene System Masse auf die Umgebung übertragen und umgekehrt. Die Systemgrenze des offenen Systems ist durchlässig für Arbeit, Wärme und Masse.
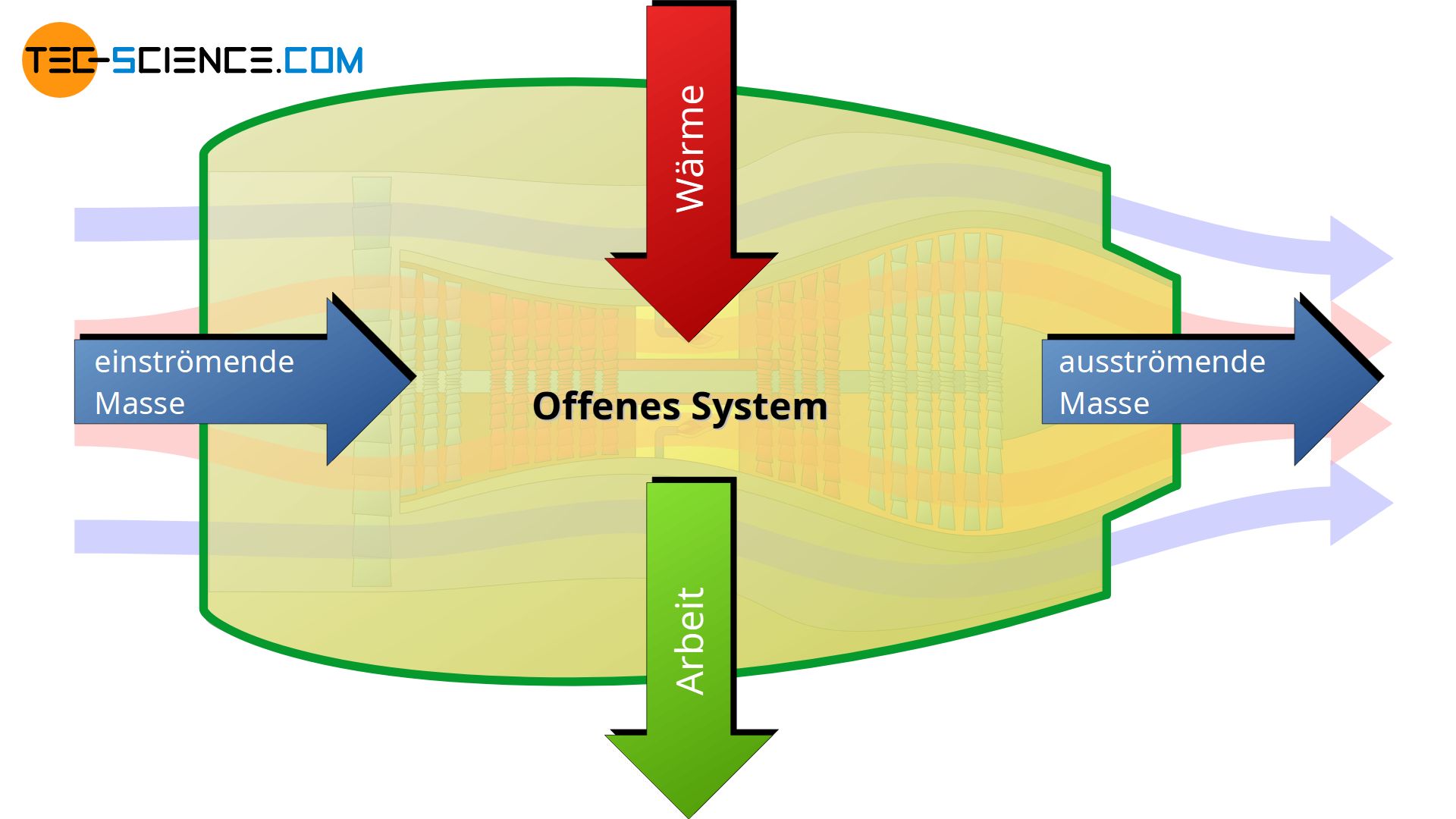
Ein typisches Beispiel für ein offenes System ist eine Turbine. Die Systemgrenze bildet in diesem Fall das Turbinengehäuse. Die Turbine saugt Luft über die Systemgrenze hinweg an, was zu einem entsprechenden Massenstrom führt. Die angesaugte Luft wird anschließend unter Arbeitsaufwand verdichtet und anschließend unter Wärmezufuhr (durch Verbrennung von Treibstoff) zur Expansion gebracht. Die Expansion des Gases führt zum Antrieb der Turbinenwelle. Dabei wird Nutzarbeit nach außen abgeführt. Anschließend verlässt der expandierte Luftstrom die Turbine.
Geschlossene thermodynamische Systeme
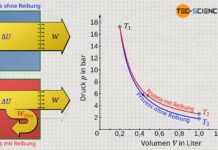
In einem geschlossenen System hingegen, kann zwar Energie in Form von mechanischer Arbeit und Wärme über die Systemgrenze hinweg ausgetauscht werden, jedoch keine Masse. Das geschlossene System ist als im Gegensatz zum offenen System somit nur durchlässig für Arbeit und Wärme.
Der Zylinder eines Verbrennungsmotors während dem Verdichtungs- und Arbeitstakt stellt bspw. ein solches geschlossenes System dar. Die Ventile schließen hierbei das System ab und verhindern damit ein ab- bzw. zuströmen von Masse. Das System wird dabei durch das Innenvolumen des Zylinders begrenzt. Die Systemgrenze ist in diesem Fall nicht etwa starr, sondern verkleinert bzw. vergrößert sich mit der Stellung des Kolbens. Wird wie beim Verdichtungstakt das Gas komprimiert so wird dem System offensichtlich Arbeit von außen zugeführt. Anschließend expandiert das Gas durch die Wärmezufuhr während der Verbrennung und dem damit verbundenen Druckanstieg, sodass gleichzeitig Arbeit an die Umgebung abgegeben wird.

Anmerkung: Wird hingegen der Ein- und Ausstoßvorgang des Treibstoff-Luft-Gemisches betrachtet, so handelt es sich aufgrund des stattfindenden Masseaustausches mit der Umgebung um ein offenes System.
Adiabate thermodynamische Systeme
Ein adiabates System kann zwar mechanische Arbeit und prinzipiell auch Masse über die Systemgrenze hinweg mit der Umgebung austauschen, jedoch keine Wärme. Es handelt sich also um eine idealisierte Vorstellung eines perfekt wärmegedämmten Systems. Dabei kann das adiabate System entweder durchlässig für Stoffströme (offenes System) oder für einen Masseaustausch undurchlässig sein (geschlossenes System).
In der Realität ist eine vollständige Wärmeisolierung nicht möglich, weshalb adiabatische Systeme nur näherungsweise erreicht werden können. Ein solcher Näherungsfall tritt zum Beispiel dann auf, wenn Zustandsänderungen so schnell ablaufen, dass für einen Wärmeaustausch mit der Umgebung kaum Zeit bleibt. Häufig werden die Kompressions- und Expansionsvorgänge in Verbrennungsmotoren oder Turbinen aufgrund der kurzen Zeiten, innerhalb deren die Zustandsänderungen ablaufen (hohe Drehzahlen), näherungsweise als in adiabatischen Systemen ablaufend betrachtet.
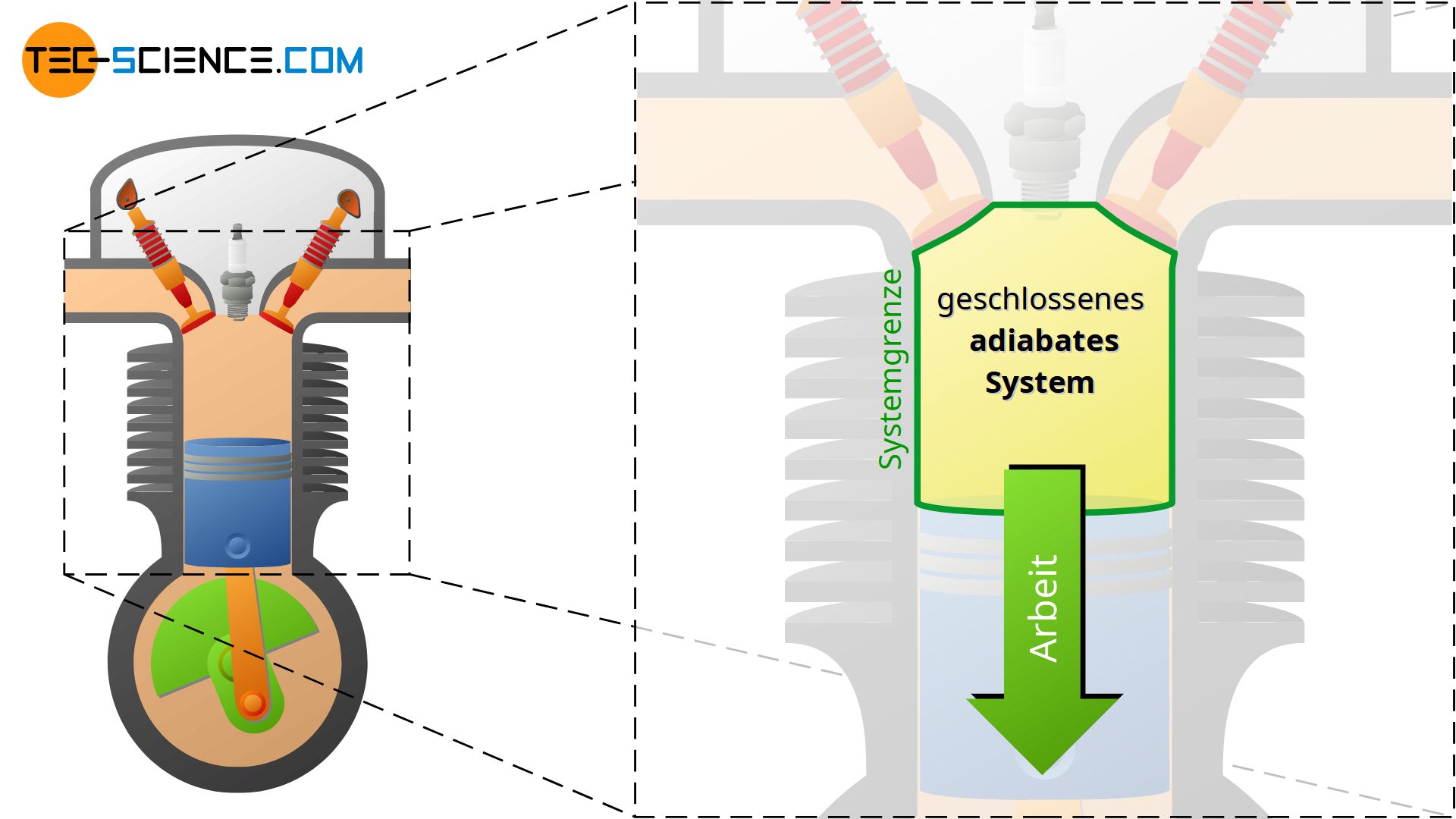
Beachte, dass im unten abgebildeten Fall der Turbine die gewählte Systemgrenze nicht die Brennkammer umfasst, sondern nur den Expansionsvorgang der heißen Gase nach der Brennkammer. Es erfolgt somit keine Wärmezufuhr für das betrachtete System! An dieser Stelle wird nochmals deutlich, dass je nach Festlegung des Systems bzw. der Systemgrenze thermodynamische Prozesse ganz anders ablaufen bzw. beschrieben werden.
Abgeschlossene thermodynamische Systeme
In einem abgeschlossenen System finden weder eine Übertragung von Masse noch ein Transport von Energie jeglicher Art auf die Umgebung und umgekehrt statt. Zwischen System und Umgebung besteht demnach keinerlei Wechselwirkung. Da ein Energieaustausch jeglicher Arbeit in solchen abgeschlossenen Systemen nicht existent ist, bleibt die innere Energie dabei stets konstant. Thermodynamisch betrachtet passiert in solchen Systemen also nichts. Ein Beispiel für ein abgeschlossenes System ist eine ideale Thermoskanne.