Bei idealen Gasen hängt die Änderung der inneren Energie direkt mit der Änderung der Temperatur zusammen.
Vereinfachte Annahmen für ideale Gase
In der Thermodynamik spielen vor allem Gase eine wichtige Rolle. Man denke an dieser Stelle bspw. an die Verbrennung eines Treibstoff-Luft-Gemisches in Verbrennungsmotoren. Um die dabei ablaufenden Vorgänge thermodynamisch zu beschreiben werden die Gase in erster Näherung als ideale Gase betrachtet. In dieser idealisierten Modellvorstellung wird von folgenden Vereinfachungen ausgegangen:
- Teilchen werden als Massepunkte ohne Ausdehnung angenommen,
- zwischen den Teilchen wirken keinerlei Bindungskräfte,
- Stoßvorgänge zwischen den Teilchen bzw. zwischen Teilchen und Grenzflächen werden als ideal elastische Stöße betrachtet.
Formen der inneren Energie für ideale Gase
Im Artikel Innere Energie wurden exemplarisch einige Energieformen genannt, die zur inneren Energie eines Stoffes zählen:
- thermische Energie (Translation und Rotation der Gasmoleküle)
- Bindungsenergie
- Chemische Energie
- Anregungsenergie
Mit den oben genannten Vereinfachungen lässt sich die innere Energie für ideale auf nur noch eine Energieform reduzieren. So schließt die Annahme, dass keinerlei Bindungskräfte zwischen den Teilchen wirken, das Vorhandensein von Bindungsenergien zwischen den Molekülen aus. Bindungsenergie findet sich also nicht als innere Energie wieder. Auch das Ablaufen chemischer Prozesse ist hierdurch ausgeschlossen, da für das Entstehen von neuen chemischen Verbindungen Bindungskräfte wirken müssten. Somit scheidet für ideale Gase auch chemische Energie als eine Form der inneren Energie aus.
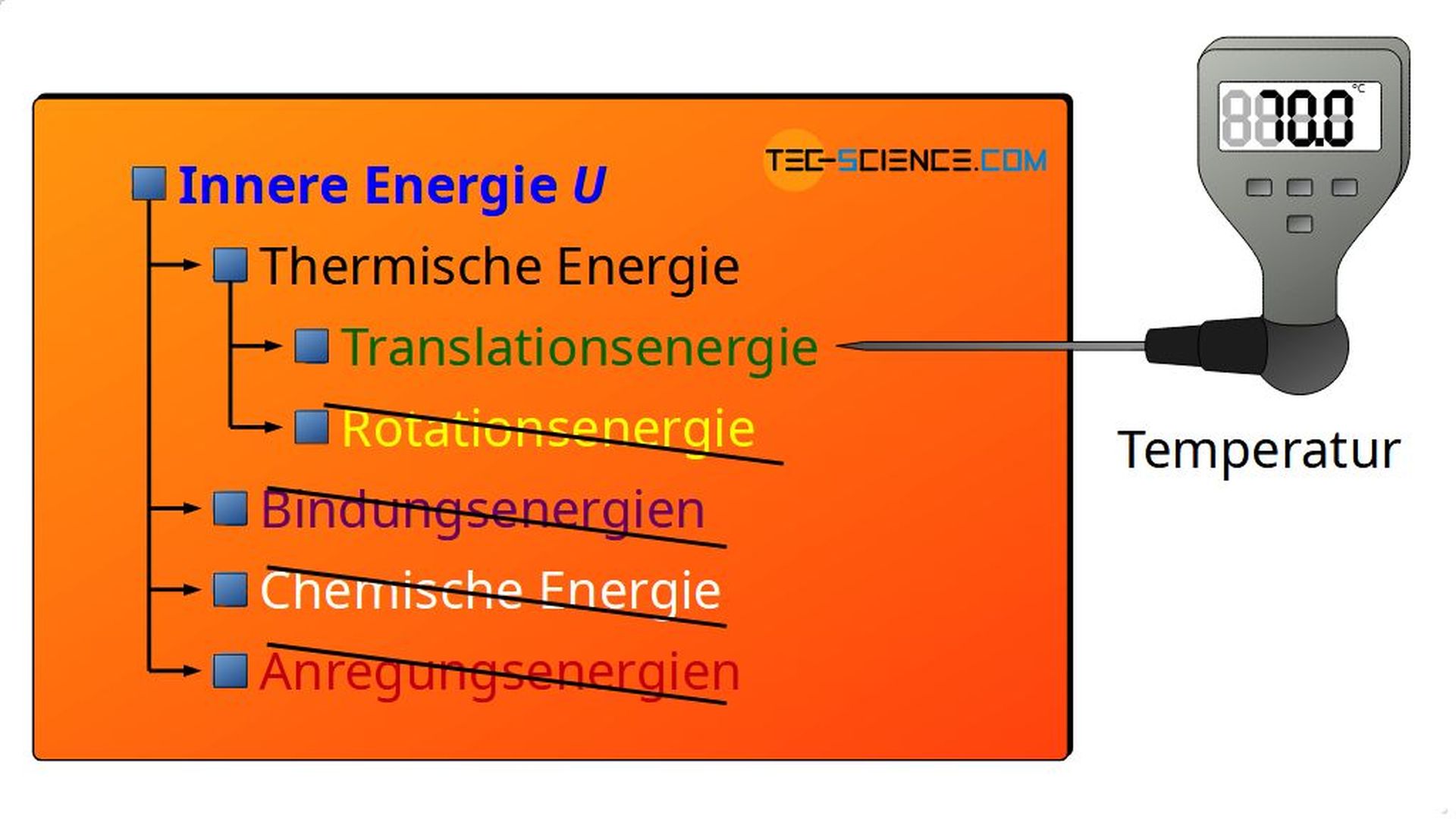
Ebenfalls ist das Anregen von Gasteilchen auf höhere Energiezustände ausgeschlossen, da bei idealen Gasen stets elastische Stoßvorgänge vorausgesetzt werden. Dies bedeutet insbesondere, dass Gasmoleküle keine Energie durch Stöße absorbieren können. Somit können auch Anregungsenergien nicht Teil der inneren Energie eines idealen Gases sein. Ferner kann sich die innere Energie eines idealen Gases auch nicht aus Rotationsenergie zusammensetzen, da die Teilchen als Massepunkte ohne Ausdehnung und somit ohne Möglichkeit zur Rotation angenommen werden.
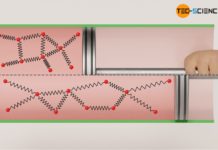
Als einzige Energieform innerhalb eines idealen Gases existiert nur die Bewegungsenergie der Gasteilchen aufgrund der ungeordneten Wärmebewegung (thermische Energie)!
Ändert sich also die innere Energie eines idealen Gases, so hat dies unmittelbaren Einfluss auf die Bewegungsenergie der einzelnen Teilchen. Gleichzeitig ist jedoch die Bewegungsenergie eines Teilchen direkt mit der Temperatur verknüpft (siehe Maxwell-Boltzmann-Verteilung). Umso höher die Temperatur eines Gases, desto größer die Bewegungsenergie der darin enthaltenen Teilchen und somit auch die innere Energie.
Umgekehrt führt eine Erniedrigung der inneren Energie zu einer Abnahme der Bewegungsenergie und damit direkt zu einer Temperaturerniedrigung. Damit lässt sich für ein ideales Gas schlussfolgern, dass jede Änderung der inneren Energie eine Temperaturänderung bedeutet bzw. umgekehrt, jede Temperaturänderung eine Änderung der inneren Energie mit sich bringt.
Für ein ideales Gas ist die innere Energie ausschließlich durch die Temperatur bestimmt!
Erster Hauptsatz der Thermodynamik
Gemäß des ersten Hauptsatzes der Thermodynamik lässt sich die innere Energie U und damit die Temperatur eines idealen Gases auf zweierlei Arten ändern. Zum einen durch einen Wärmeumsatz Q und zum anderen durch einen Arbeitsumsatz W.
\begin{align}
&\boxed{ Q+W=\Delta U } \\[5px]
\end{align}
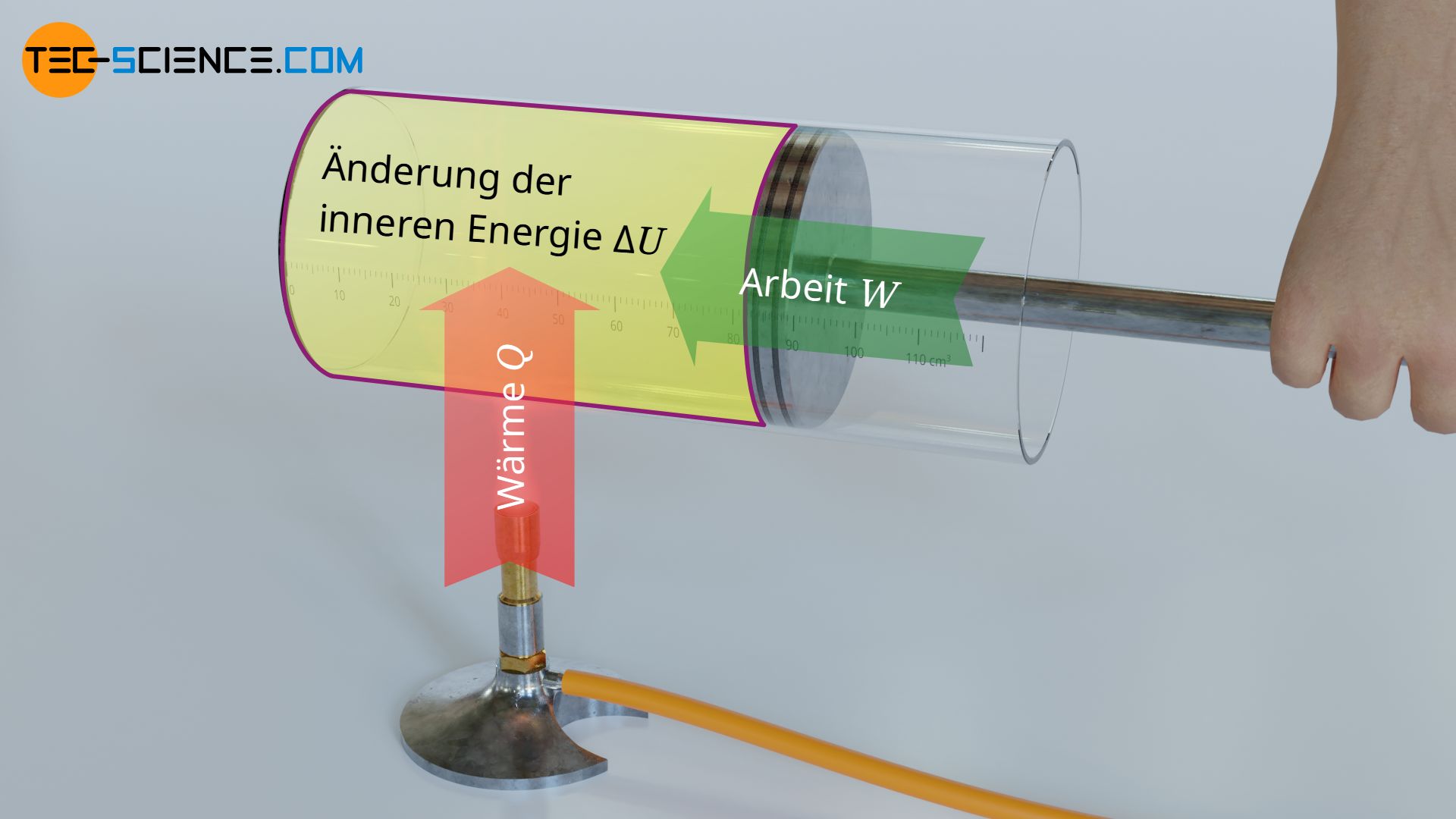
Beachte, dass dem Mechanismus der Wärmezufuhr Q und der Arbeitszufuhr W zwei grundsätzlich unterschiedliche Prinzipien zugrunde liegen. Bei der Wärmezufuhr ist zwingend ein Temperaturunterschied erforderlich, aufgrund dessen die Energieübertragung zwischen den Teilchen des heißeren und des kühleren Stoffes erfolgt. Bei der Arbeitszufuhr wird hingegen auf mechanischem Wege eine Kraft aufgebracht. Ein Temperaturunterschied als Antrieb für die Energieübertragung ist hierbei nicht nötig, auch wenn sich die Temperatur des Gases durch den Arbeitsumsatz ändert. Das Zuführen von mechanischer Arbeit erfolgt bei einem Gas durch eine Volumenverkleinerung (Kompression) – Erhöhung der inneren Energie. Gibt das Gas hingegen Arbeit an die Umgebung ab, so führt dies zu einer Volumenvergrößerung (Expansion).
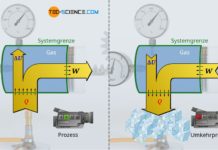
Änderung der inneren Energie am Beispiel eines Kompressors
Mithilfe des grundlegenden Zusammenhangs zwischen Wärme, Arbeit und inneren Energie (Temperatur) können bereits viele thermodynamische Vorgänge anschaulich erklärt werden. Damit lässt sich bspw. erklären, weshalb Kompressoren zur Erzeugung von Druckluft durch Kühlrippen gekühlt werden müssen. Denn durch die stattfindenden Verdichtungsvorgänge wird der zu komprimierenden Luft permanent Energie in Form von (Kompressions-)Arbeit zugeführt.

Diese Energiezufuhr durch Arbeit führt gemäß dem ersten Hauptsatz der Thermodynamik zu einer Zunahme der inneren Energie. Dies wiederum wirkt sich direkt auf die Temperatur aus, die sich folglich erhöht. Die Temperatur der komprimierten Luft steigt dabei teilweise auf über 200 °C an! Aber nicht nur bei Druckluftkompressoren, sondern auch bereits beim einfachen Aufpumpen eines Reifens mit einer Luftpumpe zeigt sich eine solche Temperaturerhöhung der Luft durch die zugeführte Kompressionsarbeit!

Um dem Ansteigen der Temperatur während der Kompressionsvorgänge entgegenzuwirken, muss dem Gas in irgendeiner Form wieder Energie entzogen werden. Dies geschieht bei Druckluftkompressoren durch Wärmeabfuhr über angebrachte Kühlrippen! Der Luft wird wird also auf der einen Seite Energie in Form von Kompressionsarbeit zugeführt, aber gleichzeitig wieder Energie durch die Wärmeabfuhr entzogen. Die innere Energie wird sich mit einer Wärmeabfuhr folglich nicht so stark ändern und die Temperaturerhöhung fällt entsprechend geringer aus.
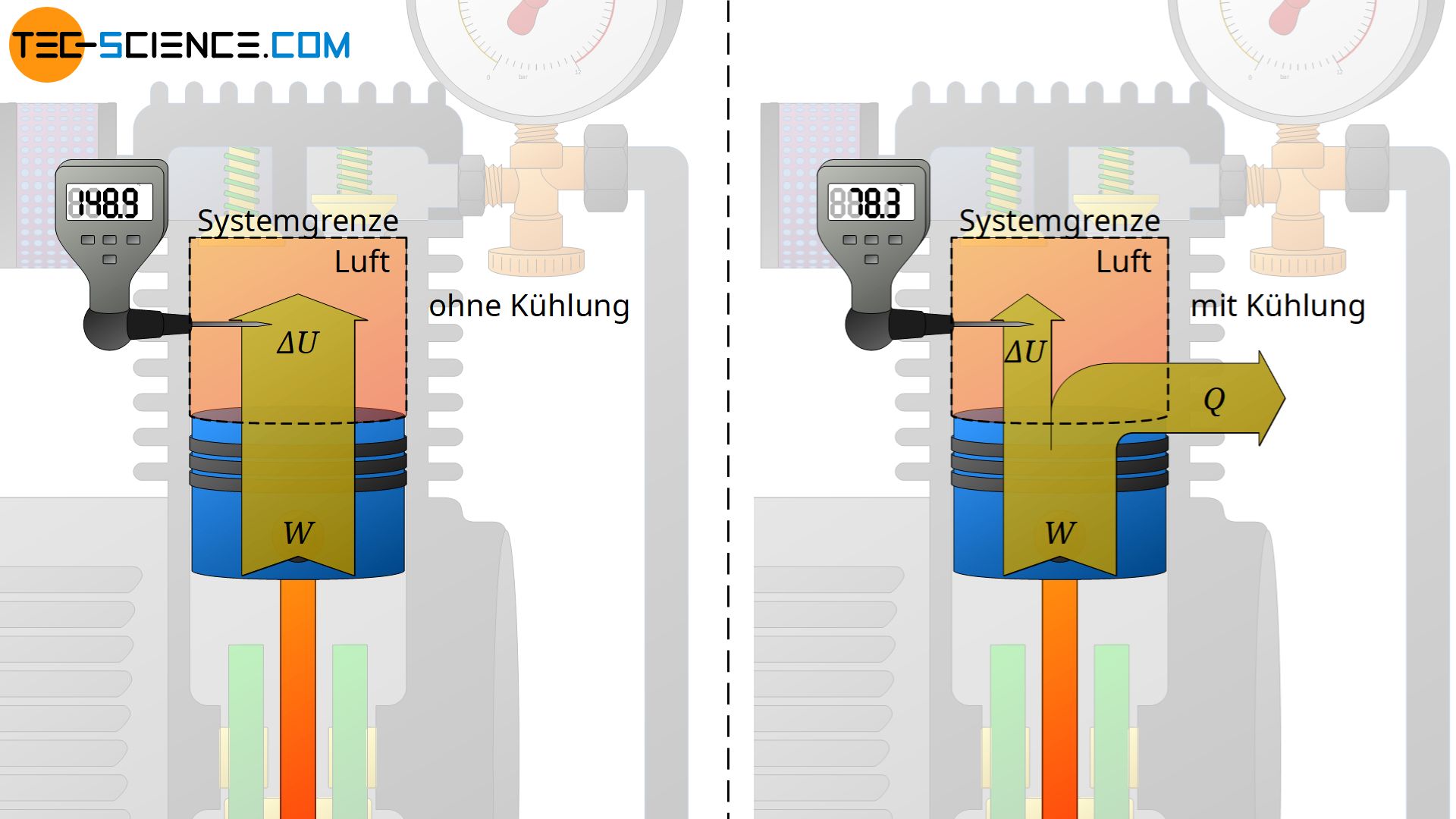
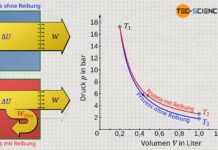
Das oben abgebildete Energieflussdiagramm zeigt anschaulich, dass im Falle ohne Wärmeabfuhr die gesamte zugeführte Kompressionsarbeit der inneren Energie des Gases und damit der Temperaturerhöhung zugutekommt. Mit Kühlung ist die Änderung der inneren Energie hingegen um den Betrag der Wärmeabfuhr geringer und die Temperaturerhöhung somit niedriger.
Im Idealfall ist die Wärmeabfuhr genauso groß wie die Arbeitszufuhr, sodass effektiv keine Energie im Gas verbleibt und sich die innere Energie damit nicht ändert. Damit würde dann auch die Temperatur konstant bleiben und sich nicht erhöhen. Ein solcher thermodynamischer Vorgang, der bei konstanter Temperatur stattfindet, wird auch als isothermer Prozess bezeichnet. Ein isothermer Kompressionsvorgang findet näherungsweise statt, wenn das Komprimieren sehr langsam durchgeführt wird. In diesem Fall kann stets genügend Wärme abgeführt werden, um ein Temperaturanstieg zu vermeiden.
Neben einer solchen qualitativen Beschreibung über die Änderung der inneren Energie bei idealen Gasen ist für die mathematisch Beschreibung jedoch auch die quantitative (zahlenmäßige) Erfassung erforderlich. Im nächsten Artikel wird auf die Berechnung der inneren Energie von idealen Gasen bzw. deren Änderung näher eingegangen.