Bei der kovalenten Bindung verwenden die beteiligten Atome gemeinsame Valenzelektronen, um die Edelgaskonfiguration zu erreichen.
Die kovalente Bindung tritt hauptsächlich bei der Verbindung zweier Nichtmetalle auf. Die an der Bindung beteiligten Atome, verwenden dabei gemeinsam („co“) Außenelektronen („valent“), um die Edelgaskonfiguration zu erreichen. Aus diesem Grund wird diese Bindungsform kovalente Bindung genannt (oder auch Elektronenpaarbindung). Etwas unpräzise wird diese auch oft als Atombindung bezeichnet. Neben Gasen hat diese Bindungsart vor allem bei Kunststoffen und Keramiken eine besondere Bedeutung.
In einer kovalenten Bindung verwenden die beteiligten Atome gemeinsame Valenzelektronen, um hierdurch die Edelgaskonfiguration zu erreichen.
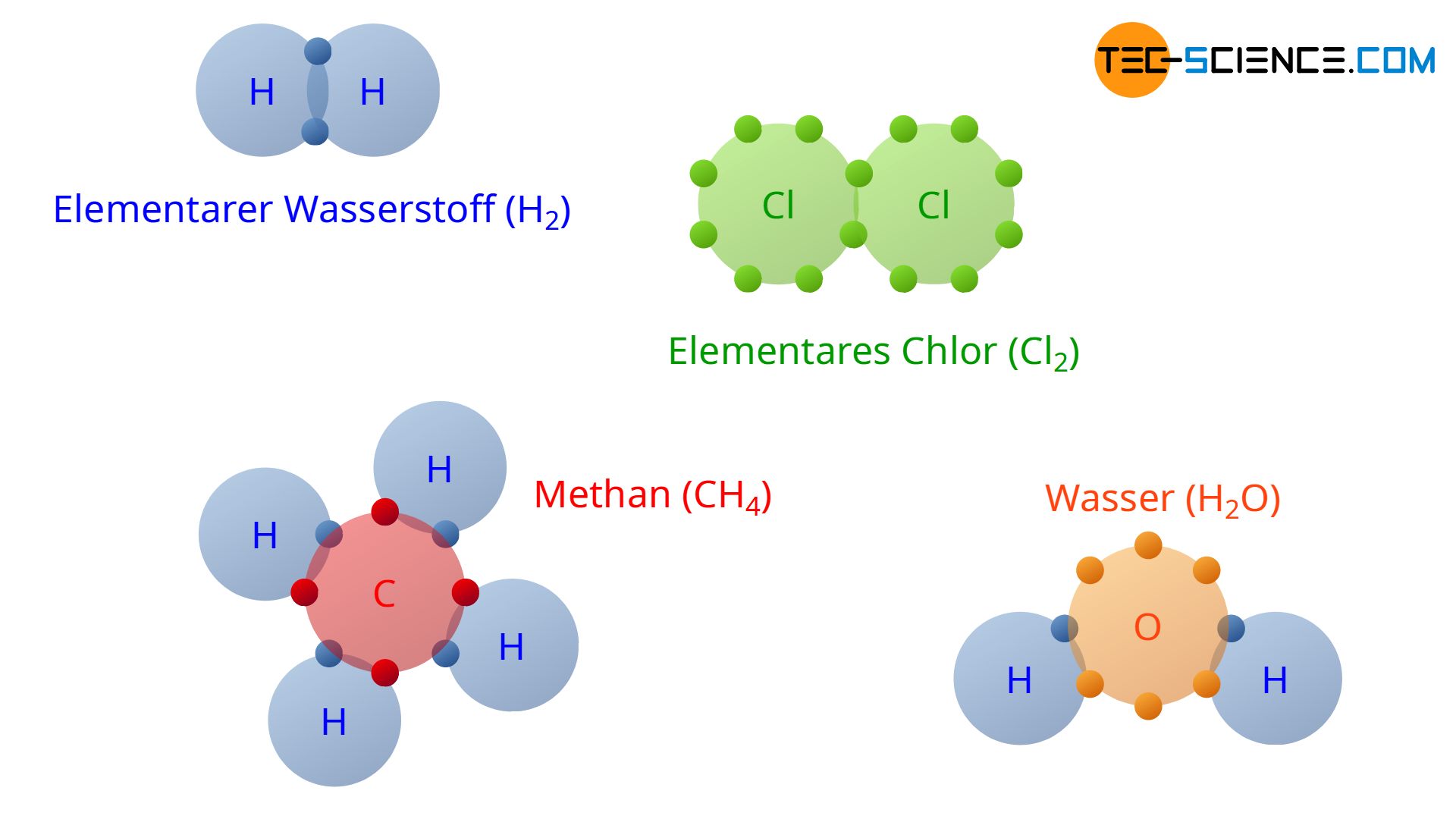
Mit Hilfe der kovalenten Bindung wird letztlich auch der Grund ersichtlich weshalb Wasserstoff in der Natur nicht als einzelnes H-Atom sondern stets als H2-Molekül auftritt (elementarer Wasserstoff). Auf diese Weise können die beiden H-Atome ihre Außenelektronen praktisch gemeinsam verwenden. Damit wird die Edelgaskonfiguration des Heliumatoms mit seinen zwei Außenelektronen erreicht.
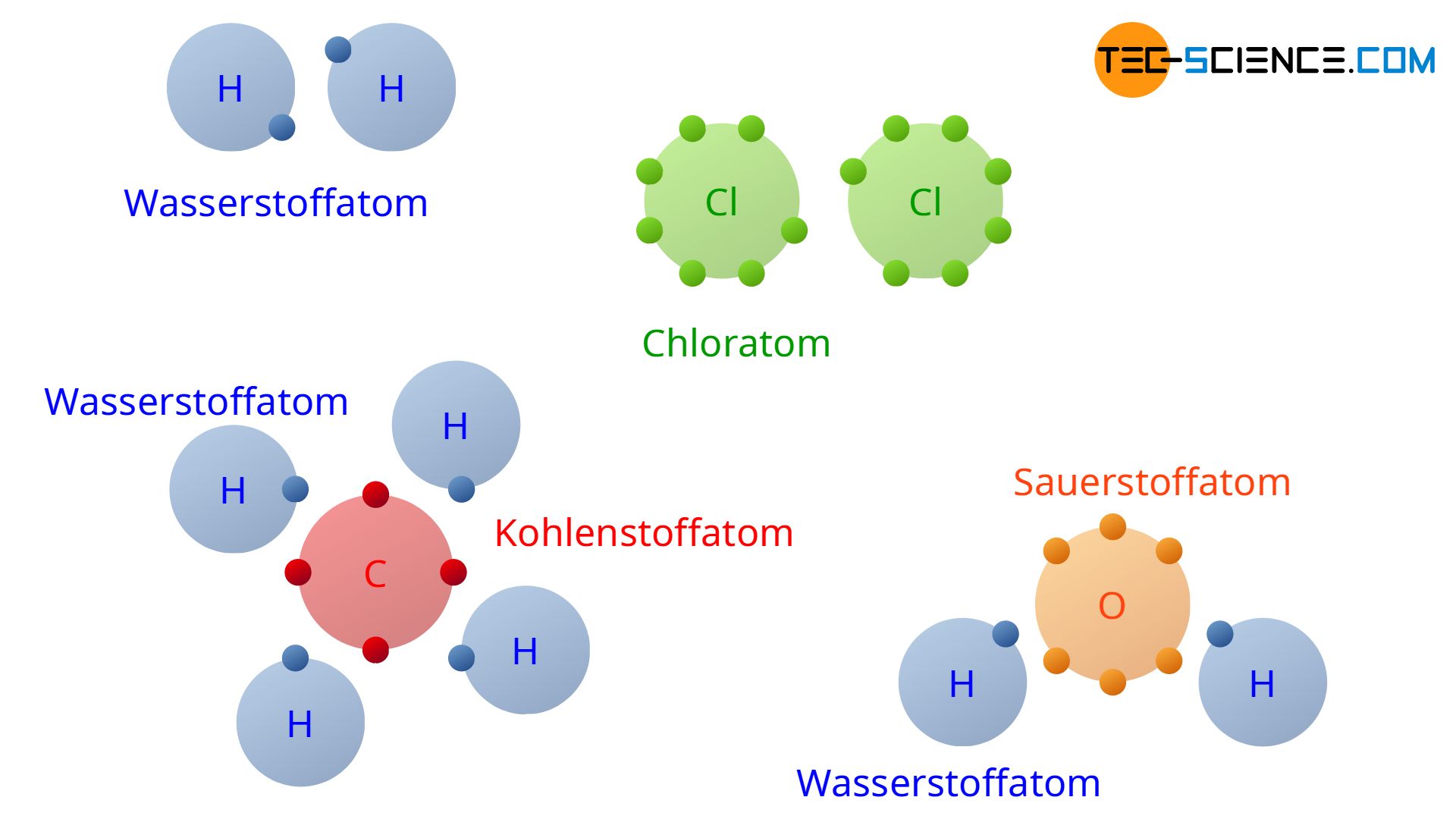
Aus demselben Grund treten auch Chlorteilchen auf elementarer Ebene stets als Molekül Cl2 auf (elementares Chlor). Die obrere Abbildung zeigt neben diesen Beispielen auch den kovalenten Zusammenschluss von vier Wasserstoffatomen (4 H) und einem Kohlenstoffatom (C) zu einem Methanmolekül (CH4). Ebenfalls ist die kovalente Bindung eines Wassermoleküls (H2O) gezeigt, bestehend aus einem Sauerstoffatom (O) und zwei Wasserstoffatomen (2H). Beachte, dass in der Abbildung lediglich die Außenelektronen der Atome abgebildet sind, da nur diese für die chemische Bindung maßgebend sind.
Die in der Animation gezeigte Darstellung der kovalenten Bindungen ist zwar sehr anschaulich, aber in vielen Fällen zu aufwendig bzw. gerade bei Doppelbindungen auch gar nicht mehr möglich. Aus diesem Grund bedient man sich der sogenannten Valenzstrichformel. Dabei werden die Valenzelektronen der einzelnen Atomen mit einem Punkt neben dem Elementsymbol dargestellt. Bei einem Wasserstoffatom mit lediglich einem Valenzelektron befindet sich somit ein Punkt rechts neben dem H-Symbol. Bei vier Außenelektronen wie bspw. beim Kohlenstoffatom befindet sich hingegen jeweils ein Punkt rechts, links, oberhalb und unterhalb des Elementsymbols. Bei Atomen mit mehr als vier Valenzelektronen kommt jeweils ein Elektron auf den Seiten hinzu. Eine solche Schreibweise wird auch als Elektronenformel bzw. Lewis-Formel bezeichnet.
Gehen die Atome mit anderen Atomen nun kovalente Bindungen ein, so werden die an der Bindung beteiligten Elektronen mit einen Strich zusammengefasst. Diese Elektronen werden dann im Speziellen auch Bindungselektronen genannt. Auf dieselbe Weise werden die übrigen Elektronenpaare eines Atoms ebenfalls mit einem Strich verbunden. Dabei handelt es sich jedoch nicht mehr um Bindungselektronen, da diese im Prinzip nichts mit der Bindung an sich zu tun haben. Auf diese Weise erhält man nun eine sehr anschauliche Information über die Bindungsverhältnisse des entstehenden Moleküls.
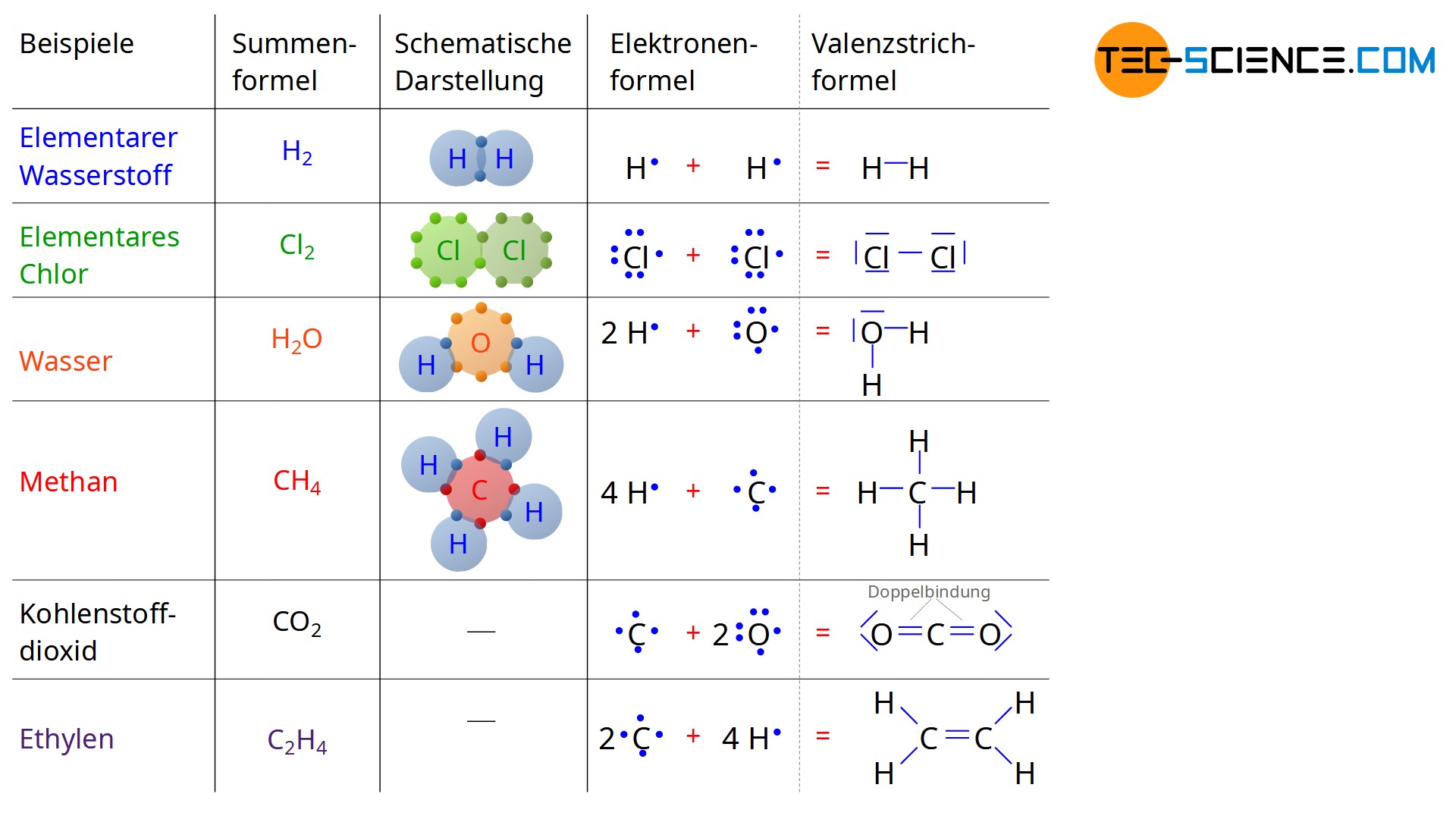
Sehr deutlich wird dabei auch die Edelgaskonfiguration, die durch die umgebenden Elektronenpaare um ein Element gebildet wird. So zeigt sich in allen abgebildeten Fällen entweder die Edelgaskonfiguration des Heliums mit zwei Außenelektronen (bzw. einem Elektronenpaar) oder die Edelgaskonfiguration mit acht Außenelektronen (bzw. vier Elektronenpaaren). Mit Hilfe dieser symbolischen Schreibweise lassen sich auch Doppelbindungen sehr anschaulich darstellen, wie sie bei Kohlenstoffdioxid (CO2) oder auch bei Ethylen (C2H4) vorkommen.
Die Valenzstrichformel macht deutlich, dass sich bei kovalenten Bindungen immer mindestens ein Elektronenpaar findet, welches gemeinsam eine chemische Bindung bildet. Aus diesem Grund wird die kovalente Bindung auch Elektronenpaarbindung genannt.
Die Schreibweise mit der lediglich die Art und die Anzahl der in einem Molekül vorkommenden Atome beschrieben wird (z.B. H2, CO2, C2H4), etc.), wird Summenformel bzw. Molekülformel genannt.