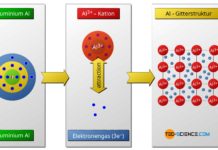
Bei der Ionenbindung geben die Metallatome ihre Außenelektronen ab, die von den Nichtmetallatomen aufgenommen werden.
Die Ionenbindung ist die vorherrschende Bindungsart bei der Verbindung eines Metalls mit einem Nichtmetall. Die an der Bindung beteiligten Metallatome geben dabei Außenelektronen ab, die von den Nichtmetallatomen aufgenommen werden. In beiden Fällen wird somit die Edelgaskonfiguration für die jeweiligen Atome erreicht.
Aus dem Metallatom wird nach Abgabe der Elektronen ein positiv geladenes Ion (Kation genannt). Aus dem Nichtmetallatom wird nach Aufnahme der Elektronen hingegen ein negativ geladenes Ion (Anion genannt). Der Zusammenhalt zwischen den Metall- und Nichtmetallatomen kommt durch die elektrostatische Anziehung den ungleichnamig geladenen Ionen zustande. Die Ionenbindung hat besondere Bedeutung für Keramiken.
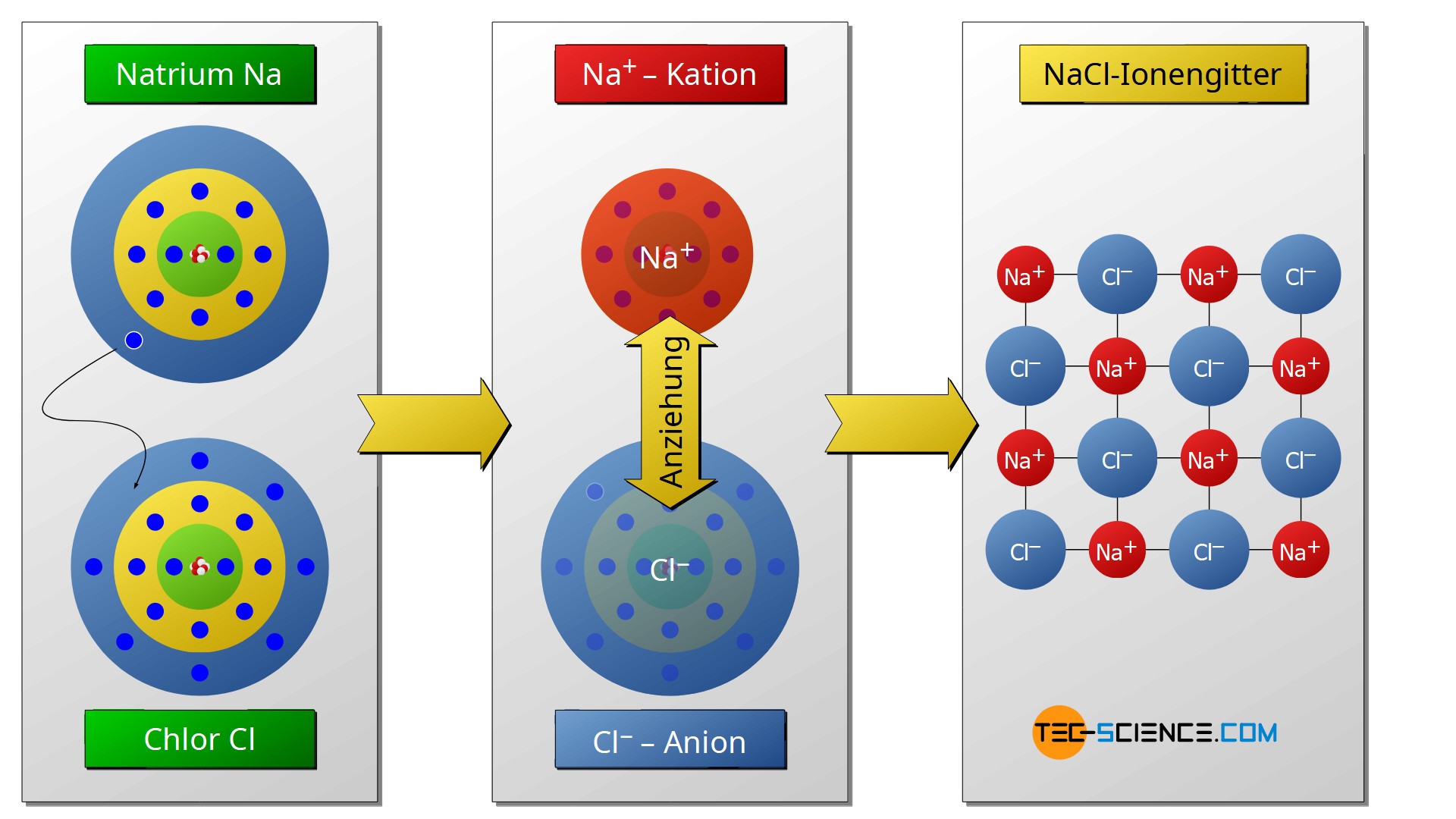
Solche gitterförmigen Verbindungen aus Anionen und Kationen werden häufig auch als Salze bezeichnet. Typisches Beispiel einer Ionenverbindung ist deshalb Kochsalz (NaCl). Bei dieser Verbindung geben die Natriumatome (Na) als Alkalimetalle ihre einzigen Außenelektronen ab. Die Metallatome verlieren somit praktisch ihre dritte M-Schale, sodass auf der darunterliegenden L-Schale die Edelgaskonfiguration mit acht Außenelektronen zum Vorschein kommt. Gleichzeitig werden die abgegebenen Außenelektronen der Natriumatome von den nichtmetallischen Chloratomen aufgenommen. Die Chloratome mit ihren eigentlich sieben Außenelektronen binden somit nun jeweils acht Außenelektronen um sich und erzielen damit die Edelgaskonfiguration. In der Folge kommt es zwischen den positiven Natriumatomen und den negativen Chloratomen zu Anziehungskräften und zur Ausbildung einer Gitterstruktur.
Als Salze bezeichnet man ionische Verbindungen bestehend aus Anionen und Kationen!
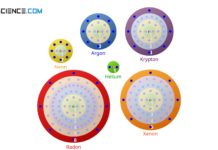
Grundsätzlich ist das Bestreben eines Atoms Elektronen an sich zu binden dann besonders groß, wenn nur wenigen Außenelektronen für die Edelgaskonfiguration fehlen. Dies trifft insbesondere für die Elemente der Gruppe der Halogene mit jeweils sieben Außenelektronen zu (z.B. Chlor). Umgekehrt ist das Bestreben Elektronen aufzunehmen bei solchen Atomen gering, die auch nur eine geringe Anzahl an Außenelektronen besitzen. Für diese ist es in der Regel energetisch günstiger die wenigen Elektronen abzugeben anstatt viele aufzunehmen. Dies trifft insbesondere für die Gruppe der Alkalimetalle zu, deren Atome nur jeweils ein Außenelektron besitzen (z.B. Na).
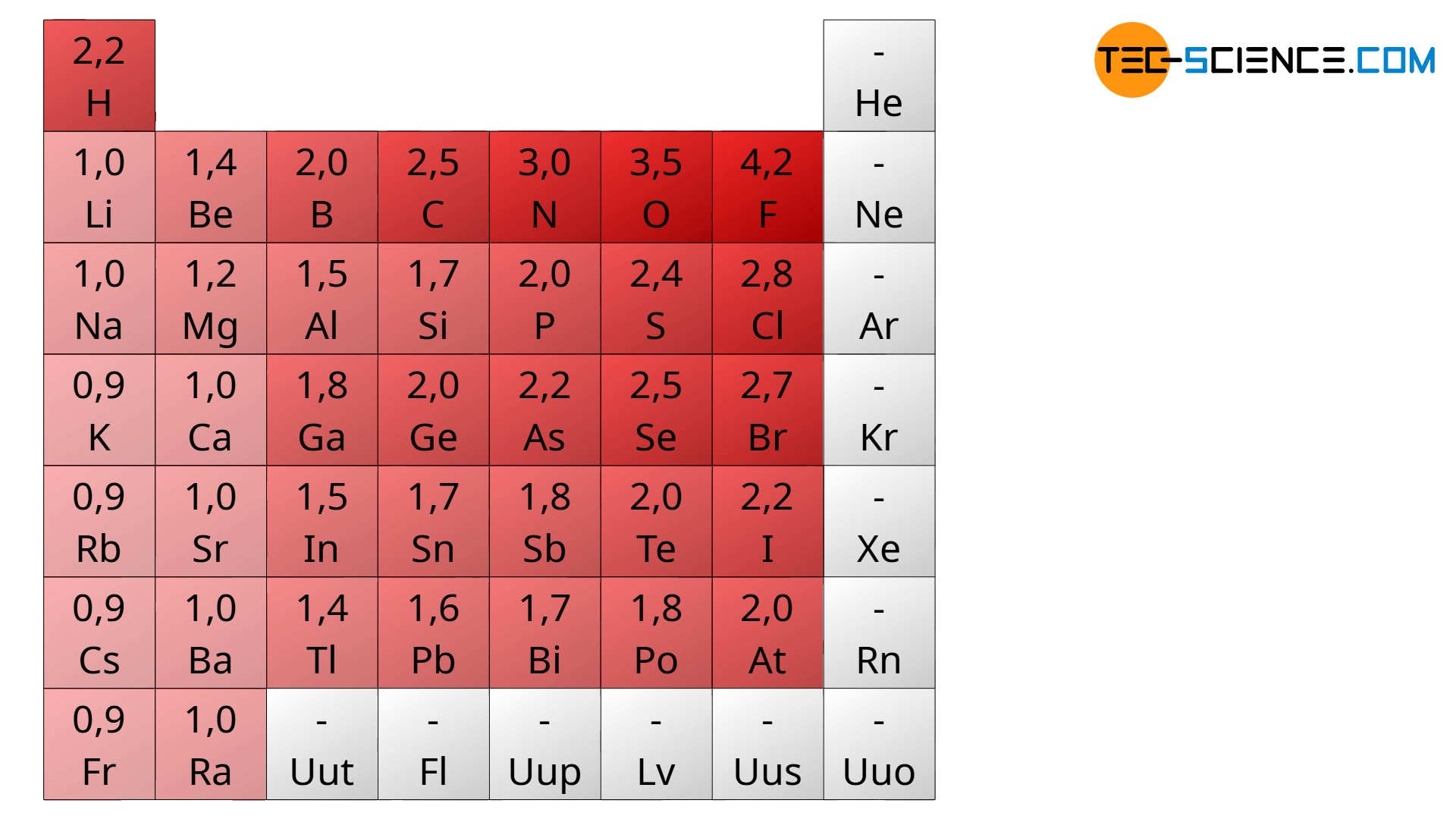
Ein solches mehr oder wenig stark ausgeprägtes Bestreben von Atomen zusätzliche Elektronen im Bindungsfall an sich zu binden, wird auch Elektronegativität genannt. Aus den oben besagten Gründen nimmt die Elektronegativität innerhalb einer Periode des Periodensystems von links nach rechts zu. Dies kann auch damit begründet werden, dass die Protonenzahl und somit die positive Wirkung des Kerns mit steigender Ordnungszahl zunimmt. Hierdurch wird die Fähigkeit des Atoms Elektronen an sich zu binden größer. Die Werte für die Elektronegativität der chemischen Elemente sind in der untenstehenden Abbildung gezeigt (je dunkler das rot, desto höher die Elektronegativität).
Innerhalb einer Gruppe nimmt die Elektronegativität hingegen in der Regel von oben nach unten ab. Grund hierfür ist der größere Abstand der Außenschale vom Atomkern, da ja mit jeder Periode eine neue Schale hinzukommt. Durch den größeren Abstand wird auch die anziehende Wirkung des Kerns auf die Valenzelektronen geringer. Dementsprechend sinkt die Fähigkeit der Atome weitere Elektronen an sich zu binden. Beachte, dass sich den Edelgasen keine Elektronegativität zuordnen lässt, da diese keine Bindungen eingehen bzw. nicht bestrebt sind Elektronen abzugeben. Ebenfalls kann den künstlich erzeugten Elementen aus praktischen Gründen kein Bindungsverhalten nachgewiesen werden.
Die Tendenz von Atomen andere Elektronen an sich zu binden wird Elektronegativität genannt. Die Elektronegativität steigt im Periodensystem von links nach rechts und nimmt von oben nach unten ab!
Ob sich eine Ionenbindung ausbildet oder nicht, hängt von der Eigenschaft der beteiligten Atome ab Elektronen abzugeben bzw. aufzunehmen. Die Nichtmetallatome sollten dabei eine möglichst große Tendenz zur Elektronenaufnahme haben (große Elektronegativität), während die Metallatome eher zur Elektronenabgabe neigen sollten (geringe Elektronegativität). Aus diesem Grund kann aus der Differenz der Elektronegativitätswerte zweier Elemente auf deren Ionenbindungscharakter geschlossen werden.
Ist die Differenz in den Elektronegativitäten zweier chemischer Elemente größer als 1,8 so wird hauptsächlich eine ionische Bindung vorliegen. Ist die Differenz hingegen geringer als 1,8 so ist vorwiegend mit einer kovalenten Bindung zu rechnen. Grundsätzlich existiert bei einer Ionenbindung jedoch immer auch ein gewisser Anteil an kovalenten Verbindungen. So weist bspw. das oben vorgestellte Natriumchlorid einen Ionenbindungscharakter von etwa 75% auf. Die restlichen 25% entfallen auf einen kovalenten Anteil.
Ist der Unterschied in den Elektronegativitäten zweier chemischer Elementen größer als 1,8, wird hauptsächlich eine ionische Bindung vorhanden sein!