Bei der Metallbindung geben die Metallatome ihre Außenelektronen ab und erreichen auf diese Weise die Edelgaskonfiguration.
Bei der Verbindung zweier Metalle zeigt sich die sogenannte Metallbindung als hauptsächliche Bindungsart. Dabei geben die Metallatome untereinander alle ihre Außenelektronen ab und erreichen somit die Edelgaskonfiguration.
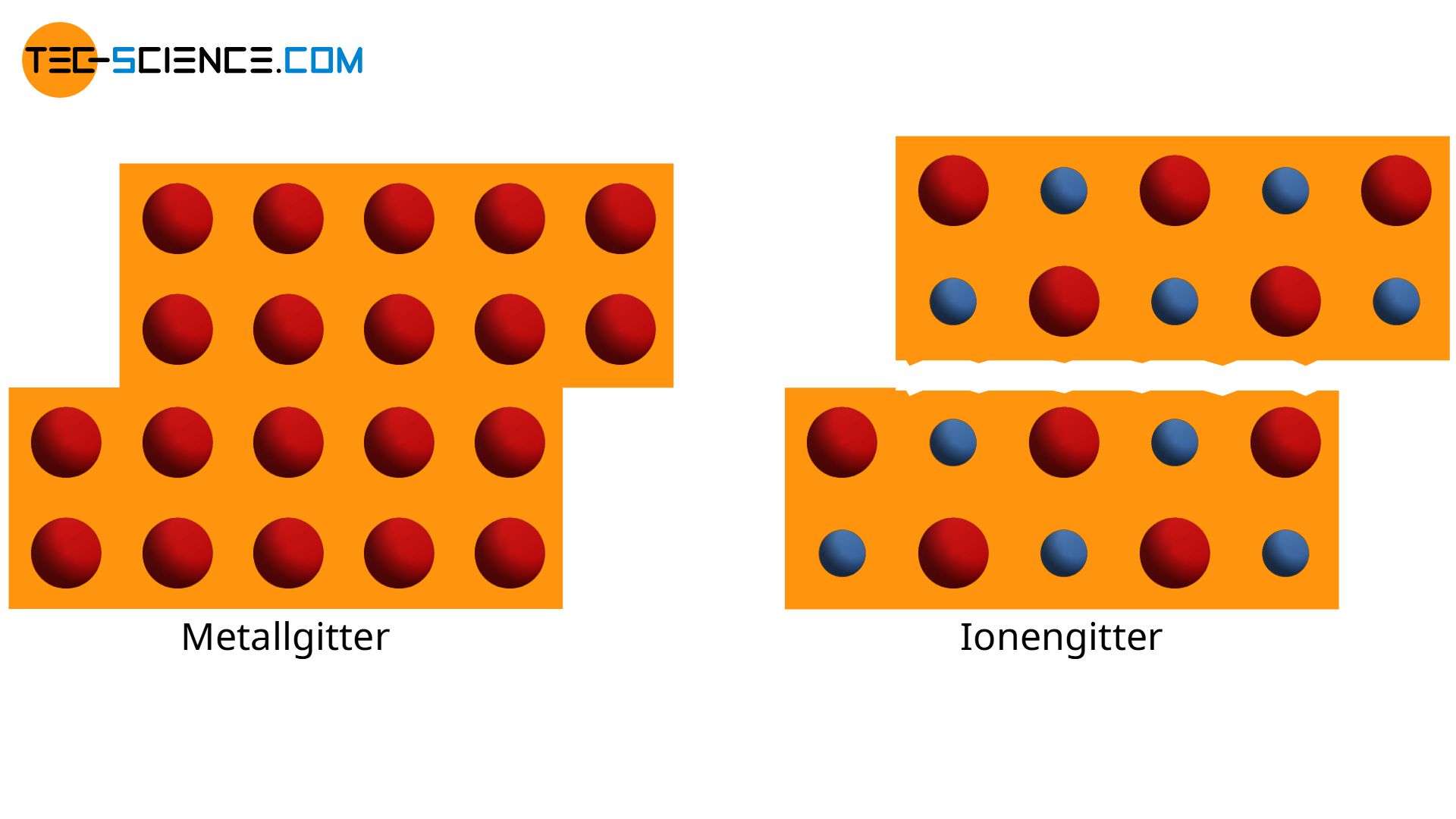
Die Metallatome werden nach Abgabe der Elektronen zu positiv geladenen Kationen. Zwischen diesen positiv geladenen Atomrümpfen bilden die abgegeben Elektronen das sogenannte Elektronengas, da sich die Elektronen praktisch wie in einem Gas frei in der Metallstruktur bewegen können. Der Zusammenhalt der Atome kommt durch die elektrostatische Anziehungskraft zwischen den positiven Atomrümpfen und dem negativen Elektronengas zustande. Wie der Name bereits andeutet, hat diese Bindungsart vor allem bei Metallen eine besondere Bedeutung.
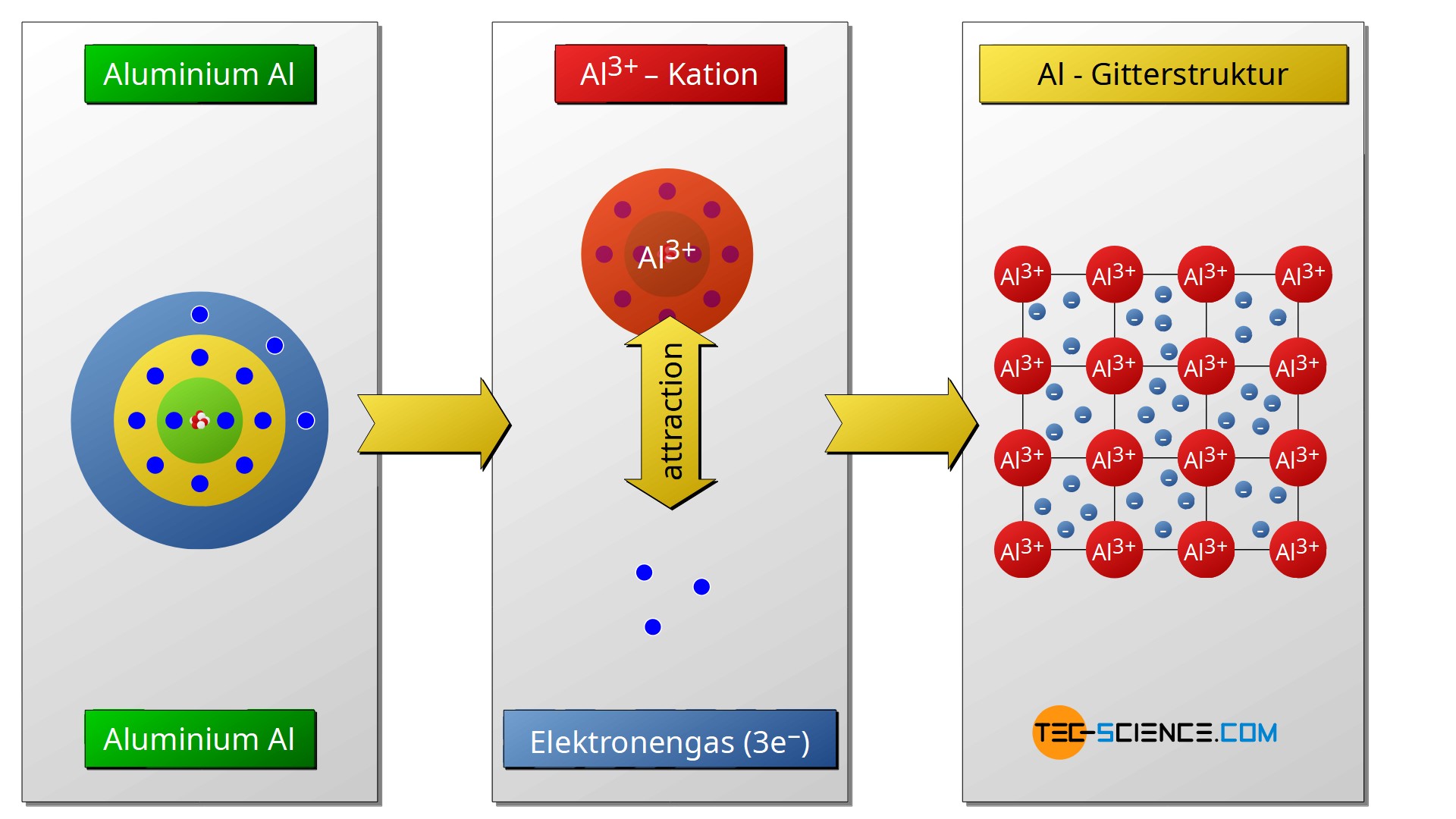
Die freie Beweglichkeit der Elektronen im Elektronengas ist letztlich auch die Ursache für die im Allgemeinen gute elektrische und thermische Leitfähigkeit der Metalle. Ausnahme von dieser Eigenschaft bildet die Gruppe der sogenannten Halbmetalle. Die gegenseitigen Abstoßungskräfte der Metall-Kationen und die gleichzeitige anziehende Wirkung des Elektronengases führen zu einer regelmäßigen Gitterstruktur.
Im Gegensatz zu den Atomrümpfen einer Ionenbindung, die aus Anionen bzw. Kationen bestehen, sind die Atomrümpfe der Metallbindung völlig identisch. Bei Verschiebung einzelner Atome bzw. ganzer Atomreihen ergeben sich in einem Metall prinzipiell keine Änderungen im atomaren Aufbau Im Gegensatz hierzu treffen bei einer Verschiebung im Ionengitter gleichartige Atomrümpfe aufeinander. Die wirkenden Abstoßungskräfte führen dann schließlich zum „Zerspringen“ des Materials. Dies ist auch der Grund weshalb Keramiken aufgrund ihres Ionenbindungscharakters sehr viel spröder sind und sich im Allgemeinen nicht wie Metalle plastisch (bleibend) verformen lassen.